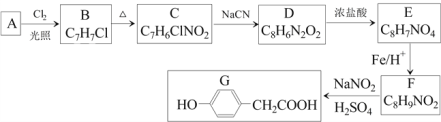
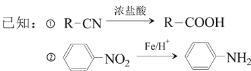
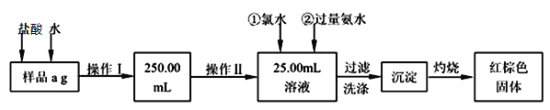
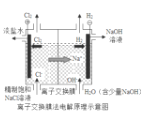
题目内容
【题目】向Na2S和Na2SO3的混合溶液中加入足量的稀硫酸溶液,发生以下反应:
________Na2S+_________Na2SO3+________H2SO4→_______Na2SO4+_______S↓+______H2O
(1)配平上述化学方程式,标出电子转移的方向和数目。________________
(2)反应中被氧化的元素是___________。
(3)反应中氧化产物和还原产物物质的量之比为__________。
【答案】2 1 3 3 3 3 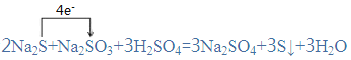 Na2S中-2价硫元素 2:1
Na2S中-2价硫元素 2:1
【解析】
向Na2SO3和Na2S的混合溶液中加入稀硫酸,溶液中会产生大量淡黄色沉淀,这主要是因为反应物中Na2S→产物中S,硫元素的化合价升高做还原剂,反应物中Na2SO3→产物中S硫元素的化合价降低做氧化剂,根据氧化还原反应中转移电子总数相等,可对该反应进行配平,电子转移的方向为从还原剂转移至氧化剂。
(1)向Na2S和Na2SO3的混合溶液中加入足量的稀硫酸溶液,发生的反应中有:
化合价升高: Na2S![]() S
S
化合价降低:Na2SO3![]() S
S
所以可配平为2Na2S+Na2SO3+3H2SO4=3Na2SO4+3S↓+3H2O
用单线桥标注电子转移的方向和数目为: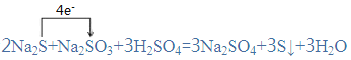
(2)反应中Na2S为还原剂,其中被氧化的元素是-2价硫元素
(3)此反应中氧化产物为由Na2S升高价态所产生的硫、还原产物为由Na2SO3降低价态所产生的硫。因此它们的物质的量之比为2:1。

 字词句段篇系列答案
字词句段篇系列答案【题目】下表是元素周期表的一部分,表中所列的字母分别代表某一元素。
B | C | D | |||||
A | E | F | |||||
(1)A的的最高价氧化物对应水化物的电子式为__________。
(2)R是由表中已标出的A~F 中某三种元素组成的化合物,是常见家用消毒剂的主要成分,其化学名称为_____________;Na2FeO4是工业常用的消毒剂,利用R 制备Na2FeO4的原理如下,请补齐缺少的物质,并配平反应方程式的系数:___ Fe(OH)3 + ___R(________) + ___ NaOH = ____ Na2FeO4 + ___ NaCl + ____H2O
(3)气态氢化物沸点:D _____ E;元素形成的简单离子的半径:A _____ D(填“>”,“<”或“=”)
(4)E 的某种氧化物通入F 单质的水溶液中,并不能增大F 单质水溶液的漂白性,请结合方程式说明______________________________________________________________。
(5)由表中未标出的某种金属元素的单质G ,可以发生如图所示的转化:
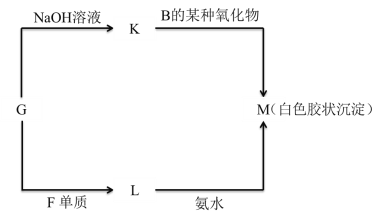
①写出 G 转化为 K 的化学方程式________________________________________。
②写出 L 转化为 M 的离子方程式________________________________________。