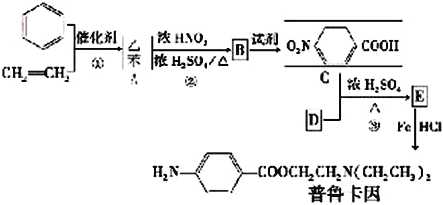
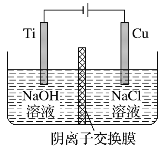
题目内容
【题目】Ⅰ、实验室常用MnO2与浓盐酸反应制备Cl2(MnO2+4HCl(浓)→MnCl2+Cl2↑+2H2O反应装置如图所示)。
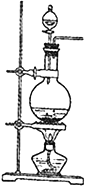
(1)装置图中的主要玻璃仪器有酒精灯、________、__________等。产生的氯气通入水中制得氯水备用。氯水含有的离子除H+、Cl-外还有___________等离子,氯水中因含有__________而具有漂白性。
Ⅱ、某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:
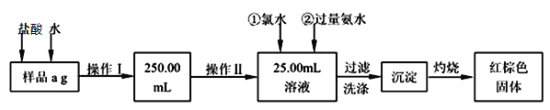
请根据上面流程,回答以下问题:
(2)样品溶解时加盐酸的作用是___________________________________。加入氯水所发生反应的离子方程式___________________________________。
(3)证明Fe3+离子已经沉淀完全的操作是___________________________________。将沉淀物加热灼烧过程中,为使实验结果准确,必须的操作为___________________。
(4)若原样品质量a 为40.00g,加热后红棕色固体质量b为2.200g,则样品中铁元素的质量分数是_________;若称量准确,最终测量的结果偏大,则造成误差的原因可能是_____________(写出一种原因即可)。
【答案】分液漏斗 圆底烧瓶 ClO- OH- HClO 抑制铁离子水解2Fe2++Cl2→2Fe3++ 2C1- 向上层清液中继续滴加氨水,无沉淀出现证明已经沉淀完全 恒重操作 0.385 沉淀未洗净或沉淀物灼烧不充分
【解析】
I、(1)装置图中的主要玻璃仪器有酒精灯、分液漏斗、圆底烧瓶等。氯气溶于水并与水反应生成盐酸和次氯酸,该反应为可逆反应。氯水含有的离子除H+、Cl-外还有ClO- 、OH-等离子,氯水中因含有HClO而具有漂白性。
Ⅱ、由流程可知:样品经溶解后配制成250.00mL溶液,然后取出25.00mL溶液,加入氯水充分氧化后加入过量氨水把铁离子沉淀,将沉淀分离后灼烧得到氧化铁。根据样品的质量和最后所得氧化铁的质量可以计算出样品中铁的质量分数。
(2)样品溶解时加盐酸的作用是抑制铁离子水解。加入氯水所发生反应的离子方程式2Fe2++Cl2→2Fe3++ 2C1-。
(3)证明Fe3+离子已经沉淀完全的操作是:向上层清液中继续滴加氨水,无沉淀出现证明已经沉淀完全。将沉淀物加热灼烧过程中,为使实验结果准确,应保证氢氧化铁完全分解,故必须的操作为恒重操作。
(4)若原样品质量a 为40.00g,加热后红棕色固体氧化铁的质量b为2.200g,则样品中铁元素的质量分数是 0.385;若称量准确,最终测量的结果偏大,则造成误差的原因可能是:沉淀未洗净或沉淀物灼烧不充分而使最终得到的红棕色固体质量偏大。
0.385;若称量准确,最终测量的结果偏大,则造成误差的原因可能是:沉淀未洗净或沉淀物灼烧不充分而使最终得到的红棕色固体质量偏大。