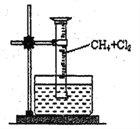
题目内容
【题目】某校兴趣小组用如图I装置制取漂白液(气密性已检验,试剂已添加),并研究其相关性质。

(1)为保证氯气的充分利用,应采取的操作是__________________________。
(2)饱和食盐水的作用是__________________________________________。
(3)若用图II装置收集多余的氯气。请在虚线框内画出该装置简图,(请画在答题卡上) _____。
(4)该小组同学用上述装置制得的漂白液中NaClO的浓度偏低。查阅资料发现,在溶液中发生反应:
①Cl2+2NaOH=NaCl+NaClO+H2O ②3NaC1O=2NaCl+NaClO3
已知反应①②均为放热反应,且反应①的反应速率很快,而反应②需要在较高的温度下进行,在室温下反应速率较慢,根据资料,请对图I装置提出改进建议:______________________。
(5)修改方案后,该小组同学制得了较高浓度的NaClO溶液,他们把漂白液和滴有酚酞的红色Na2SO3溶液混合后,得到无色溶液。
提出猜想:
i. NaClO把Na2SO3氧化了
ii. NaClO把酚酞氧化了
iii. NaClO把Na2SO3和酚酞均氧化了
①下列实验方案中可以证明NaClO氧化了Na2SO3的是________
a.向混合后的溶液中加入过量盐酸
b.向混合后的溶液中加入过量盐酸,再加入氯化钡熔液
c.向混合后的溶液中加入过量硝酸,再加入硝酸银溶液
d.向混合后的溶液中加入氢氯化钡溶液,再加入过量盐酸
②为证明NaClO氧化了酚酞,可进行的实验是____________。
【答案】 根据气泡速度控制分液漏斗的活塞,使浓盐酸缓慢流下 除去氯气中的氯化氢 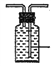 将盛NaOH溶液的洗气瓶浸在冰水中 bd 向混合后的溶液中加入NaOH溶液,若溶液不变红,说明酚酞已经被氧化;若溶液变红,说明酚酞没有被氧化
将盛NaOH溶液的洗气瓶浸在冰水中 bd 向混合后的溶液中加入NaOH溶液,若溶液不变红,说明酚酞已经被氧化;若溶液变红,说明酚酞没有被氧化
【解析】考查实验方案设计与评价,(1)保证氯气的充分利用,需要根据气泡的速度控制分液漏斗的活塞,使浓盐酸缓慢流下;(2)制备出的氯气中混有HCl,HCl与NaOH反应生成NaCl,使漂白液的纯度降低,必须除去HCl,即饱和食盐水的目的是除去氯气中的HCl;(3)装置II是收集多余氯气,应用排饱和食盐水的方法收集氯气,短进长出,装置图为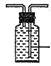 ;(4)根据信息,反应②在较高的温度下才能进行,常温下反应速率较慢,因此将盛NaOH溶液的洗气瓶浸在冰水中;(5)a、加入过量的盐酸,无现象,故a错误;b、加入过量的盐酸,再加入BaCl2溶液,出现白色沉淀,此沉淀为BaSO4,说明Na2SO3被NaClO氧化,故b正确;c、加入过量硝酸,硝酸具有强氧化性,能把Na2SO3氧化成Na2SO4,加入硝酸银产生Ag2SO4沉淀,对Cl-的检验产生干扰,故c错误;d、向混合后的溶液中加入氢氧化钡溶液,生成白色沉淀,加入盐酸,沉淀不溶,说明NaClO把Na2SO3氧化成Na2SO4,故d正确;(6)向混合后的溶液中加入NaOH溶液,若溶液不变红,说明酚酞已经被氧化;若溶液变红,说明酚酞没有被氧化。
;(4)根据信息,反应②在较高的温度下才能进行,常温下反应速率较慢,因此将盛NaOH溶液的洗气瓶浸在冰水中;(5)a、加入过量的盐酸,无现象,故a错误;b、加入过量的盐酸,再加入BaCl2溶液,出现白色沉淀,此沉淀为BaSO4,说明Na2SO3被NaClO氧化,故b正确;c、加入过量硝酸,硝酸具有强氧化性,能把Na2SO3氧化成Na2SO4,加入硝酸银产生Ag2SO4沉淀,对Cl-的检验产生干扰,故c错误;d、向混合后的溶液中加入氢氧化钡溶液,生成白色沉淀,加入盐酸,沉淀不溶,说明NaClO把Na2SO3氧化成Na2SO4,故d正确;(6)向混合后的溶液中加入NaOH溶液,若溶液不变红,说明酚酞已经被氧化;若溶液变红,说明酚酞没有被氧化。