题目内容
7.在化学反应中,随着物质的变化,必然包含能量的变化.已知:破坏1mol氢气中的化学键需要吸收436kJ能量;破坏1mol氧气中的化学键需要496kJ的能量;形成水分子中1molH-O键能够释放463kJ能量.如图是2H2+O2=2H2O反应过程中能量变化图,请在标注的数字序数处,填出能量变化的数值或根据箭头的指向填写能量变化是“放出”热量还是“吸收”热量.

①1370kJ②1852kJ③482KJ④吸收.
分析 ①2molH2和1molO2断裂化学键吸收能量,根据断裂的化学键计算;
②4moLH原子和2molO原子生成2molH2O形成4molO-H键,以此计算放出的能量;
③可根据反应热等于反应物的总键能减去生成物的总键能计算;
④液态水转变成气态水要吸收热量.
解答 解:①2molH2和1molO2断裂化学键吸收能量,吸收的能量为2×436kJ+2×249kJ=1370kJ,故答案为:1370kJ;
②4moLH原子和2molO原子生成2molH2O形成4molO-H键,放出的能量为:4×463kJ=1852kJ,故答案为:1852kJ;
③反应热等于反应物的总键能减去生成物的总键能,则2molH2和1molO2生成2molH2O放出热量为1852kJ-1370KJ=482KJ,故答案为:482KJ;
④液态水转变成气态水要吸收热量,故答案为:吸收.
点评 本题考查反应热的计算,题目难度不大,解答本题的关键是把握如何利用键能计算反应热.

练习册系列答案
相关题目
17.下列各组中的物质作用时,反应条件或反应物的量发生变化,对产物无影响的是( )
| A. | Na+O2 | B. | Cu+Cl2 | C. | NaOH溶液+CO2 | D. | C+O2 |
15.下列关于Fe(OH)3胶体的说法不正确的是( )
| A. | Fe(OH)3胶体与硅酸胶体(硅酸胶体微粒带负电荷)混合将产生聚沉现象 | |
| B. | Fe(OH)3胶体粒子在电场影响下将向正极运动 | |
| C. | Fe(OH)3胶体粒子不停地做布朗运动 | |
| D. | 光线通过Fe(OH)3胶体时会产生丁达尔效应 |
2.“关注民生”和“科学发展”是“十七大”报告的主题之一,下列有关叙述符合科学规律的是( )
| A. | 纳米铜能在氧气中燃烧,说明了纳米铜比普通铜的还原性强 | |
| B. | 白色污染与塑料垃圾有关 | |
| C. | 臭氧空洞的形成与化石燃料大量使用有关 | |
| D. | “海水淡化”可以解决“淡水供应危机”,向海水中加入净水剂明矾可以使海水淡化 |
12.下列关于常见有机物的说法不正确的是( )
| A. | 乙酸和油脂都能与氢氧化钠溶液反应 | |
| B. | 检验乙醇中是否含有水可加入少量无水硫酸铜,若变蓝色则含水 | |
| C. | 在淀粉溶液中加入20%的稀硫酸水解后,立即加入新制Cu(OH)2悬浊液共热,证明有葡萄糖生成 | |
| D. | 在鸡蛋白溶液中加入(NH4)2SO4饱和溶液,有沉淀析出,再加入蒸馏水振荡,沉淀溶解 |
19.下列叙述不正确的是( )
| A. | 生铁中含有碳,抗腐蚀能力比纯铁弱 | |
| B. | 在铁制品上镀铜时,石墨为阳极,铁制品作阴极,铜盐为电镀液 | |
| C. | 用锡焊接的铁质器件,焊接处易生锈 | |
| D. | 燃气灶上的炒锅支架容易生锈,主要是由于高温下铁易发生“化学腐蚀” |
16.用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | NO2和H2O反应毎生成2mol HNO3时转移的电子数目为2NA | |
| B. | 1mol苯分子中含有3NA个碳碳单键 | |
| C. | 24g NaH中阴离子所含电子总数为NA | |
| D. | 在0.1mol/LK2CO3溶液中,阴离子数目大于0.1NA |
9. 目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2+3H2?CH3OH+H2O,该反应的能量变化如图所示:
目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2+3H2?CH3OH+H2O,该反应的能量变化如图所示:
(1)甲同学认为该反应为放热反应,他的理由为:反应物的总能大于生成物的总能量
(2)在体积为2L的密闭容器中,充入1mol CO2和3mol H2,测得CO2的物质的量随时间变化如表所示.从反应开始到5min末,用CO2浓度变化表示的平均反应速率v(CO2)=0.05mol/(L.min);
反应达到平衡状态,此时H2的转化率为75%.
(3)在相同温度、容积不变的条件下,能说明该反应已达平衡状态的是bd(填序号).
a.v生成(CH3OH)=v消耗(CO2)
b.CO2、H2、CH3OH、H2O的浓度均不再变化
c.n(CO2):n(H2):n(CH3OH):n(H2O)=1:1:1:1
d.H2的消耗速率与CH3OH的消耗速率之比为3:1.
 目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2+3H2?CH3OH+H2O,该反应的能量变化如图所示:
目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2+3H2?CH3OH+H2O,该反应的能量变化如图所示:(1)甲同学认为该反应为放热反应,他的理由为:反应物的总能大于生成物的总能量
(2)在体积为2L的密闭容器中,充入1mol CO2和3mol H2,测得CO2的物质的量随时间变化如表所示.从反应开始到5min末,用CO2浓度变化表示的平均反应速率v(CO2)=0.05mol/(L.min);
反应达到平衡状态,此时H2的转化率为75%.
| t/min | 0 | 2 | 5 | 10 | 15 |
| n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
a.v生成(CH3OH)=v消耗(CO2)
b.CO2、H2、CH3OH、H2O的浓度均不再变化
c.n(CO2):n(H2):n(CH3OH):n(H2O)=1:1:1:1
d.H2的消耗速率与CH3OH的消耗速率之比为3:1.

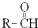 +
+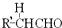 $\stackrel{OH-}{→}$
$\stackrel{OH-}{→}$ (-R、-R’表示氢原子或烃基)用B和C为原料按如下路线合成A:
(-R、-R’表示氢原子或烃基)用B和C为原料按如下路线合成A: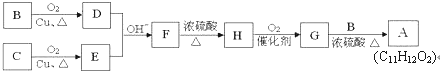
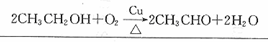
 .
.
 .
.