题目内容
17.下列各组中的物质作用时,反应条件或反应物的量发生变化,对产物无影响的是( )| A. | Na+O2 | B. | Cu+Cl2 | C. | NaOH溶液+CO2 | D. | C+O2 |
分析 A、根据Na和O2反应的条件的不同,生成物也不同;
B、Cu+Cl2生成氯化铜;
C、根据NaOH和少量CO2反应的产物是碳酸钠,与过量CO2反应的产物是碳酸氢钠;
D、根据C和少量氧气生成CO;与过量的氧气生成二氧化碳;
解答 解:A、Na和O2在常温下反应生成氧化钠,Na和O2在加热条件下反应生成过氧化钠,反应条件改变,会引起产物的种类改变,故A错误;
B、Cu+Cl2生成氯化铜,生成物不随反应条件或反应物的用量变化而变化,故B正确;
C、NaOH和少量CO2反应,CO2不足时生成碳酸钠,CO2过量时生成碳酸氢钠,反应物用量比改变,会引起产物的种类改变,故C错误;
D、C和少量氧气生成CO;与过量的氧气生成二氧化碳,反应物用量比改变,会引起产物的种类改变,故D错误;
故选B.
点评 本题是对物质之间反应物量的不同导致的结果不同的考查,解题的关键是掌握具体的反应产物的不同,属于物质之间反应的探讨.

练习册系列答案
相关题目
5.已知Fe3O4可表示成FeO•Fe2O3,水热法制备Fe3O4纳米颗粒的总反应为:
3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4 O62-+2H2O.下列说法正确的是( )
3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4 O62-+2H2O.下列说法正确的是( )
| A. | O2和S2O32-是氧化剂,Fe2+是还原剂 | |
| B. | 每生成1 mol Fe3O4,转移电子的物质的量为2 mol | |
| C. | 若有2 mol Fe2+被氧化,则被Fe2+还原的O2为0.5 mol | |
| D. | 参加反应的氧化剂与还原剂的物质的量之比为1:1 |
12.下列有关物质转化的叙述不正确的是( )
| A. | SiO2→H2SiO3、CuO→Cu(OH)2、CuSO4→CuCl2均不能通过一步反应实现 | |
| B. | FeS、FeCl2、Fe(OH)3均可以通过化合反应制得 | |
| C. | 水在化学反应中可能只做氧化剂、或只做还原剂、或既不做氧化剂也不做还原剂、或既做氧化剂又做还原剂 | |
| D. | 在某一复分解反应中,也有可能弱酸是反应物,而强酸是生成物 |
2.对于X+Y?Z的平衡,若增大压强,Y的转化率增大,则X和Z可能的状态是( )
| A. | X为液态,Z为气态 | B. | X为固态,Z为气态 | C. | X为气态,Z为气态 | D. | 无法确定 |
9.用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 标准状况下,22.4 L SO3中含有O数目为3.0NA | |
| B. | 常温常压下,12.2 gNaHSO4中含有离子总数为0.3NA | |
| C. | 在1 L 0.1 mol•L-1碳酸钠溶液中,阴离子总数大于0.1NA | |
| D. | 某密闭容器盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子的数目为0.6NA |
6.下列说法正确的是( )
| A. | 物质发生化学反应时都伴随着能量变化,伴随能量变化的物质变化一定是化学变化 | |
| B. | 太阳能、煤气、潮汐能是一次能源;电力、蒸汽、地热是二次能源 | |
| C. | 吸热反应就是反应物的总能量比生成物的总能量高;也可以理解为化学键断裂时吸收的能量比化学键形成时放出的能量少 | |
| D. | 由3O2(g)=2O3(g)△H>0,可知臭氧比氧气的化学性质更活泼 |
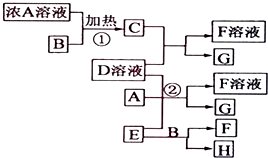 以下均为中学化学常见物质,存在如图转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H.
以下均为中学化学常见物质,存在如图转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H.
