题目内容
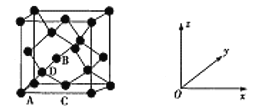
【题目】元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表,思考扇形元素周期表的填充规律,推出图中标记的11种元素,回答下列问题:
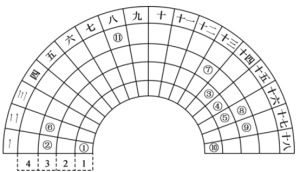
(1)⑤的简单阴离子的结构示意图为_______,的原子序数为___________。
(2)④的简单氢化物的电子式为__________________。
(3)在11种元素中,单质的化学性质最不活泼的是__________(填化学式)。
(4)⑧、⑨两种元素形成的最高价氧化物的水化物中,酸性较强的是_______(填化学式)。
(5)加热时,③的单质能和⑧的最高价氧化物的水化物的浓溶液发生反应,化学方程式为___________。
(6)⑦在元素周期表中的位置是_____________。
【答案】![]() 26
26 ![]() He HC1O4 C+2H2SO4 (浓)
He HC1O4 C+2H2SO4 (浓)![]() CO2↑+2H2 O+2SO2 ↑ 第三周期第III A 族
CO2↑+2H2 O+2SO2 ↑ 第三周期第III A 族
【解析】
①在第一周期第一列,①是H元素;⑩在第一周期第18列,⑩是He元素;②、⑥、⑦、⑧、⑨在第三周期第1、2、13、16、17列,②、⑥、⑦、⑧、⑨分别是Na、Mg、Al、S、Cl元素;③、④、⑤分别在第二周期第14、15、16列,③、④、⑤分别是C、N、O元素;在第四周期第8列,是Fe元素,据此分析解答。
(1)⑤是O元素,形成的简单阴离子是O2-,核外有10个电子,离子结构示意图为![]() ;是Fe元素,Fe的原子序数为26;
;是Fe元素,Fe的原子序数为26;
(2)④是N元素,其气态氢化物是氨气,电子式为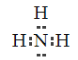 ;
;
(3)在11种元素中,元素He是稀有气体,结构稳定,所以化学性质最不活泼的是He;
(4)⑧⑨分别是S、Cl,同周期元素从左到右非金属性增强,非金属性S<Cl,非金属性越强,最高价氧化物对应水化物的酸性越强,所以两种元素形成的最高价氧化物的水化物中酸性较强的是HClO4;
(5)③的单质是C,⑧是S,硫元素的最高价氧化物的水化物是硫酸,碳与浓硫酸反应生成二氧化碳、二氧化硫、水,反应的化学方程式是C+2H2SO4(浓)![]() CO2↑+2H2O+2SO2↑;
CO2↑+2H2O+2SO2↑;
(6)⑦是Al元素,在元素周期表中的位置是第三周期ⅢA族。

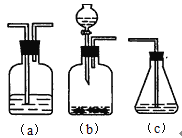
【题目】利用如图装置探究铜粉与下列试剂的反应,在试管中加入一定量铜粉,加入试剂后,立即塞上橡胶塞,实验现象如下表所示,下列推断不正确的是( )
资料:Cu2++4NH3![]() [Cu(NH3)4]2+, [Cu(NH3)4]2+呈绛蓝色。
[Cu(NH3)4]2+, [Cu(NH3)4]2+呈绛蓝色。
装置 | 序号 | 试剂 | 现象 |
| ① | 10 mL浓NH3·H2O,3 mLH2O | 溶液变为绛蓝色,左侧水柱上升 |
② | 10 mL浓NH3·H2O,3 mL H2O2 | 溶液变为绛蓝色,且比①深 | |
③ | 10 mL 20% HNO3溶液,3 mL H2O | 溶液快速变蓝,产生无色气体,左侧水柱下降 | |
④ | 10 mL 20% HNO3溶液,3 mL H2O2 | 溶液变蓝比③慢,产生无色气体,左侧水柱下降 |
A.①中实验现象说明O2参与了反应
B.②中溶液颜色比①深可能是由于H2O2氧化Cu生成Cu2+
C.③中左侧水柱下降可能是反应产生NO气体导致的
D.④比③变蓝慢是由于H2O2分解造成自身消耗
【题目】在密闭容器中发生下列反应:I2(g)+H2(g)![]() 2HI(g)(正反应为放热反应)。起始时,n(H2)=a mol,n(I2)=b mol。只改变表中列出的条件,其他条件不变,试将化学反应速率的改变填入相关的表格中(填“增大”“减小”或“不变”)。
2HI(g)(正反应为放热反应)。起始时,n(H2)=a mol,n(I2)=b mol。只改变表中列出的条件,其他条件不变,试将化学反应速率的改变填入相关的表格中(填“增大”“减小”或“不变”)。
编号 | 改变的条件 | 反应速率 |
(1) | 升高温度 | ______ |
(2) | 加入正催化剂 | ______ |
(3) | 再充入a mol H2 | ______ |
(4) | 将容器的容积扩大到原来的2倍 | ______ |
(5) | 保持容积不变,通入b mol Ne | ______ |