题目内容
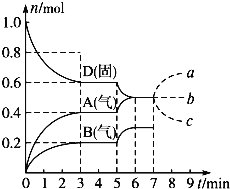
【题目】一定温度下,恒容密闭容器中发生N2(g)+3H2(g)![]() 2NH3(g)反应,反应速率与反应时间的关系如图所示。对两种平衡状态下各物理量的比较错误的是( )
2NH3(g)反应,反应速率与反应时间的关系如图所示。对两种平衡状态下各物理量的比较错误的是( )

A.平衡状态Ⅱ时的c(H2)一定小B.平衡状态Ⅱ时的c(NH3)一定大
C.平衡常数K一样大D.平衡状态Ⅱ时的v(正)一定大
【答案】A
【解析】
A. 若通入氢气,平衡向着正向移动,但平衡时c(H2)增大,故A错误;
B. 由于平衡向着正向移动,且逆反应速率逐渐增大,则平衡状态Ⅱ时的c(NH3)一定大,故B正确;
C. 平衡常数与温度有关,温度不变,则两个平衡状态下的平衡常数K不变,故C正确;
D. 根据图象可知,平衡状态Ⅱ时的v(正)、V(逆)都一定增大,故D正确;
故选:A。

练习册系列答案
 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案
相关题目