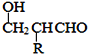题目内容
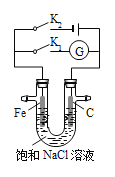
【题目】锌灰是炼锌厂的烟道灰,含ZnO 35%以上,还含有少量的氧化锰(MnO)、氧化铜、 铁的氧化物和不溶于酸的杂质,工业上常用酸浸法回收 ZnSO4·7H2O。已知 ZnSO4·7H2O 晶体易溶于水,难溶于酒精,某兴趣小组实验室模拟回收 ZnSO4·7H2O 晶体,流程如下:

请回答:
(1)分析步骤 II 中的操作和原理, 回答下列问题:
①结合表 1、 2,分析选择的 pH 及温度分别是______________________, 其中, 可以采用加入_________________________来调节 pH ;
表1 pH对ZnSO4.7H2O 回收量及纯度的影响
pH | ZnSO4.7H2O 回收量(g) | 产品中Fe的含量% | 产品中其他重金属含量% |
1 | 114.32 | 0.750 | 0.059 |
2 | 114.4 | 0.086 | 0.056 |
3 | 113.68 | 0.034 | 0.054 |
4 | 113.60 | 0.010 | 0.050 |
5 | 112.43 | 0.010 | 0.050 |
表2 温度对ZnSO4.7H2O 回收量及纯度的影响
温度 (℃) | ZnSO4.7H2O 回收量(g) | 产品中F的含量% | 产品中其他重金属含量% |
20 | 111.45 | 0.011 | 0.052 |
40 | 112.89 | 0.010 | 0.051 |
60 | 113.30 | 0.010 | 0.050 |
80 | 113.80 | 0.010 | 0.050 |
90 | 114.40 | 0.091 | 0.048 |
②酸性 KMnO4 溶液将溶液中的 Fe2+氧化,生成两种沉淀;同时,过量的高锰酸钾在微酸性的条件能自动分解生成MnO2 沉淀。试写出在该环境下,KMnO4 溶液氧化 Fe2+的离子反应方程式_________________________________________。 若用稀硝酸做氧化剂,除了产物中可能含有 Zn(NO3)2 外,还可能的缺点是:_________________________;
(2)分析整个实验过程中,回答下列问题:
①滤渣 B 的主要成分为___________________________;
②如何检验滤液B中是否含有铁元素_____________________________________;
③写出生成滤渣C的离子方程式__________________________________________;
(3)为测定 ZnSO4·7H2O 晶体的纯度,可用 K4Fe(CN)6 标准液进行滴定。主要原理如下:2K4Fe(CN)6+ 3ZnSO4= K2Zn3[Fe(CN)6]2↓+ 3K2SO4
准确称取 5.000g ZnSO4·7H2O 晶体,用蒸馏水溶解并定容至 250mL,准确移取该溶液 25.00mL至锥形瓶中,用 0.0500mol/L K4Fe(CN)6 溶液进行滴定,所得数据如下表:
实验次数 | 滴定前读数/mL | 滴定后读数/mL |
1 | 0.10 | 19.92 |
2 | 1.34 | 21.12 |
3 | 0.00 | 20.10 |
则 ZnSO4·7H2O 晶体的纯度是_______________(以质量分数表示,保留到小数点后两位)。
【答案】4,60oC ZnO MnO4- + 3Fe2+ + 7H2O = MnO2↓+ 3Fe(OH)3↓+ 5H+ 产生氮氧化合物污染环境 氢氧化铁、二氧化锰 在试管中取少量滤液B,滴加2滴KSCN溶液,若溶液变红则有铁元素,不变红则无铁元素 Zn + Cu2+ == Zn2+ + Cu 85.24%
【解析】
(1)①从表1可以看出,pH=4时,杂质含量最少,且ZnSO4.7H2O 回收量相对较多;温度60℃时,总体看,杂质含量最少,且ZnSO4.7H2O 回收量相对较多;从不引入杂质的角度考虑,可以采用加入ZnO来调节pH;
②由题意知,KMnO4 溶液氧化Fe2+,生成MnO2和Fe(OH)3。若用稀硝酸做氧化剂,除了产物中可能含有 Zn(NO3)2 外,还可能的缺点是:硝酸被还原,生成氮的氧化物;
(2)①滤渣 B 的主要成分为MnO2和Fe(OH)3;
②滤液B中如果含有铁元素,则为Fe3+,所以应使用KSCN溶液;
③用Zn处理的是Cu2+,所以生成滤渣C应为Cu;
(3)从表中数据看,实验3的数据为失真数据,前两次实验中,K4Fe(CN)6 溶液的体积平均为19.8mL。设样品中含ZnSO4·7H2O晶体的纯度为x

![]()
(1)①从表1可以看出,pH=4时,杂质含量最少,且ZnSO4.7H2O 回收量相对较多;温度60℃时,总体看,杂质含量最少,且ZnSO4.7H2O 回收量相对较多;从不引入杂质的角度考虑,可以采用加入ZnO来调节pH;答案为:4,60oC;ZnO;
②由题意知,KMnO4 溶液氧化Fe2+,生成MnO2和Fe(OH)3,然后利用电子守恒、质量守恒进行配平,即得MnO4- + 3Fe2+ + 7H2O = MnO2↓+ 3Fe(OH)3↓+ 5H+。若用稀硝酸做氧化剂,除了产物中可能含有 Zn(NO3)2 外,还可能的缺点是:硝酸被还原,生成氮的氧化物;答案为:MnO4- + 3Fe2+ + 7H2O = MnO2↓+ 3Fe(OH)3↓+ 5H+;产生氮氧化合物污染环境;
(2)①滤渣 B 的主要成分为MnO2和Fe(OH)3;答案为:氢氧化铁、二氧化锰;
②滤液B中如果含有铁元素,则为Fe3+,所以应使用KSCN溶液;答案为:在试管中取少量滤液B,滴加2滴KSCN溶液,若溶液变红则有铁元素,不变红则无铁元素;
③用Zn处理的是Cu2+,所以生成滤渣C应为Cu,反应的离子方程式为Zn + Cu2+ == Zn2+ + Cu;答案为:Zn + Cu2+ == Zn2+ + Cu;
(3)从表中数据看,实验3的数据为失真数据,前两次实验中,K4Fe(CN)6 溶液的体积平均为19.8mL。设样品中含ZnSO4·7H2O晶体的纯度为x

![]() 。答案为:85.24%。
。答案为:85.24%。

【题目】利用如图装置探究铜粉与下列试剂的反应,在试管中加入一定量铜粉,加入试剂后,立即塞上橡胶塞,实验现象如下表所示,下列推断不正确的是( )
资料:Cu2++4NH3![]() [Cu(NH3)4]2+, [Cu(NH3)4]2+呈绛蓝色。
[Cu(NH3)4]2+, [Cu(NH3)4]2+呈绛蓝色。
装置 | 序号 | 试剂 | 现象 |
| ① | 10 mL浓NH3·H2O,3 mLH2O | 溶液变为绛蓝色,左侧水柱上升 |
② | 10 mL浓NH3·H2O,3 mL H2O2 | 溶液变为绛蓝色,且比①深 | |
③ | 10 mL 20% HNO3溶液,3 mL H2O | 溶液快速变蓝,产生无色气体,左侧水柱下降 | |
④ | 10 mL 20% HNO3溶液,3 mL H2O2 | 溶液变蓝比③慢,产生无色气体,左侧水柱下降 |
A.①中实验现象说明O2参与了反应
B.②中溶液颜色比①深可能是由于H2O2氧化Cu生成Cu2+
C.③中左侧水柱下降可能是反应产生NO气体导致的
D.④比③变蓝慢是由于H2O2分解造成自身消耗