题目内容
7.一定温度下,A、B两瓶乙酸的浓度分别是1mol/L和0.1mol/L,则A、B两瓶乙酸溶液中[H+]之比<10(填“<”、“>”或“=”),并简述理由稀释过程中乙酸电离平衡正向移动,促进电离.分析 乙酸存在电离平衡,将其浓度稀释10倍,因电离平衡正向移动,c(H+)大于原来溶液中c(H+)的$\frac{1}{10}$.
解答 解:在相同温度下,将1mol/L的CH3COOH溶液加水稀释至原体积的10倍,则浓度变为原来浓度的$\frac{1}{10}$,所以稀释后浓度为0.01mol/L,因稀释过程中乙酸电离平衡正向移动,因此0.1mol/L乙酸溶液中c(H+)大于原溶液中c(H+)的$\frac{1}{10}$,因此前者与后者的c(H+)比值小于10.
故答案为:<;稀释过程中乙酸电离平衡正向移动,促进电离.
点评 本题考查了弱酸存在电离平衡且其浓度越小电离程度越大,题目难度不大.

练习册系列答案
相关题目
17.下列实验操作中错误的是( )
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时应使温度计水银球与蒸馏烧瓶支管口平齐 | |
| C. | 蒸发时,待蒸发皿中没有水了再停止加热 | |
| D. | 称量氢氧化钠时,应先将小烧杯放在左盘称量,再将药品加入到小烧杯中称量 |
15.常温下,100mL 0.1mol•L-1的三种盐溶液NaX、NaY、NaZ的pH分别为7、8、9,则下列比较中正确的是( )
| A. | HX、HY、HZ的酸性依次增强 | |
| B. | 溶液中的离子浓度c(X-)<c(Y-)<c(Z-) | |
| C. | 电离常数K(HY)>K(HZ),水解常数K(Y-)>K(Z-) | |
| D. | c(X-)=c(Y-)+c(HY)=c(Z-)+c(HZ) |
12.为了配制100mL 1mol•L-1的NaOH溶液,其中有下列几个操作:①NaOH固体放在纸上进行称量 ②选刚用蒸馏水洗净的100mL容量瓶进行配制 ③NaOH在烧杯里刚好完全溶解,立即把溶液转移到容量瓶中 ④用蒸馏水洗涤烧杯内壁和玻璃棒2次,洗涤液也均转入容量瓶中 ⑤使蒸馏水沿玻璃棒注入容量瓶,直到溶液的凹液面恰好与刻度线相切.其中错误的是( )
| A. | ①②③ | B. | ③④⑤ | C. | ②③⑤ | D. | ①③⑤ |
19.下列分离或提纯物质的方法正确的是( )
| A. | 用蒸发法进行海水淡化 | |
| B. | 用酒精萃取碘水中的碘 | |
| C. | 用渗析的方法除去淀粉溶液中含有的少量NaCl | |
| D. | 用加热→蒸发的方法可以除去粗盐中的CaCl2、MgCl2等杂质 |
2.氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性;还原剂的还原性大于还原产物的还原性.现有以下反应( )
①Cl2+2KBr═2KCl+Br2,②KClO3+6HCl═3Cl2+KCl+3H2O,③2KBrO3+Cl2═Br2+2KClO3,
下列说法正确的是.
①Cl2+2KBr═2KCl+Br2,②KClO3+6HCl═3Cl2+KCl+3H2O,③2KBrO3+Cl2═Br2+2KClO3,
下列说法正确的是.
| A. | 上述三个反应都有单质生成,所以都是置换反应 | |
| B. | 氧化性由强到弱顺序为 KBrO3>KClO3>Cl2>Br2 | |
| C. | 反应②中还原剂与氧化剂的物质的量之比为6:1 | |
| D. | ③中lmol还原剂反应则氧化剂得到电子的物质的量为2mol |
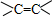 、醛基-CHO、羧基-COOH、-COOR酯基.
、醛基-CHO、羧基-COOH、-COOR酯基.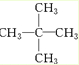 ,名称为2,2-二甲基丙烷.
,名称为2,2-二甲基丙烷.