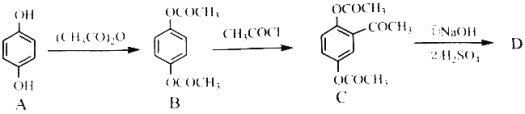
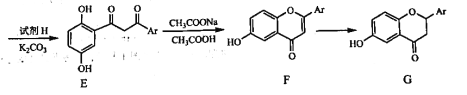
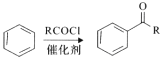
题目内容
【题目】铁氧体是一种磁性材料,具有广泛的应用。
(1)铁元素位于元素周期表的_________区,其基态原子有___________种能量不同的电子。
(2)工业制备铁氧体常使用水解法,制备时常加入尿素[CO(NH)2]2、醋酸钠等碱性物质,尿素分子中四种不同元素的电负性由大到小的顺序是________,醋酸钠中碳原子的杂化类型是_______。
(3)纳米氧化铁能催化火箭推进剂NH4ClO4的分解,![]() 的结构式为___________(标出配位键),与
的结构式为___________(标出配位键),与![]() 互为等电子体的分子有____________(任写一种)。铵盐大多不稳定,NH4F、NH4I中,较易分解的是_______________。
互为等电子体的分子有____________(任写一种)。铵盐大多不稳定,NH4F、NH4I中,较易分解的是_______________。
(4)晶体Fe3O4的晶胞如图所示,该晶体是一种磁性材料,能导电。
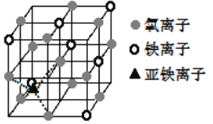
①晶胞中亚铁离子处于氧离子围成的_______________(填空间结构)空隙。
②晶胞中氧离子的堆积方式与某金属晶体原子堆积方式相同,该堆积方式名称为______。
③解释Fe3O4晶体能导电的原因_________;若晶胞的体对角线长为a nm,则Fe3O4晶体的密度为_____________g·cm-3(阿伏加德罗常数用NA表示)。
【答案】d 7 O>N>C>H sp3杂化、sp2杂化 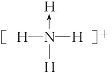 CCl4 NH4F 正四面体 面心立方最密堆积 电子可在两种不同价态的铁离子间快速发生转移
CCl4 NH4F 正四面体 面心立方最密堆积 电子可在两种不同价态的铁离子间快速发生转移 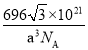
【解析】
(1) 铁是26号元素,电子排布式为1s22s22p63s23p63d64s2,据此分析解答;
(2)元素的非金属性越强,其电负性越大;根据价层电子对互斥理论判断C原子杂化方式;
(3) ![]() 中N原子形成3个N-H键和1个配位键,据此分析判断
中N原子形成3个N-H键和1个配位键,据此分析判断![]() 的结构式;根据原子总数相等、价电子总数也相等的微粒互为等电子体分析书写;F原子半径比I原子小,H--F更易形成,更易夺取
的结构式;根据原子总数相等、价电子总数也相等的微粒互为等电子体分析书写;F原子半径比I原子小,H--F更易形成,更易夺取![]() 中的H+;
中的H+;
(4)根据晶胞结构结合常见微粒的堆积方式分析解答①和②,对于③可以根据均摊法计算该晶胞中氧离子和Fe元素微粒的个数,从而计算晶胞的质量,晶胞的体对角线程度为anm,据此计算晶胞棱长,从而计算晶胞的体积,再结合密度=![]() 计算。
计算。
(1)铁是26号元素,处于周期表中第四周期第Ⅷ族,电子排布式为1s22s22p63s23p63d64s2,属于d区元素,同一能级中电子能量相同,不同能级中的电子能量不相同,故共有7种能量不同的电子,故答案为:d;7;
(2)元素的非金属性越强,其电负性越大,非金属性O>N>C>H,则电负性O>N>C>H;醋酸钠中甲基上C原子价层电子对个数是4、羧基上C原子价层电子对个数是3,根据价层电子对互斥理论,C原子杂化方式分别为sp3、sp2,故答案为:O>N>C>H;sp3杂化、sp2杂化;
(3) ![]() 中N原子形成3个N-H键,N原子提供1对电子给氢离子形成1个配位键,其结构式为
中N原子形成3个N-H键,N原子提供1对电子给氢离子形成1个配位键,其结构式为 ,其空间构型为正四面体形;ClO4-是5原子、32e-的离子,与ClO4-互为等电子体的分子为CCl4;F原子半径比I原子小,H-F键比H-I键强,H-F更易形成,易夺取
,其空间构型为正四面体形;ClO4-是5原子、32e-的离子,与ClO4-互为等电子体的分子为CCl4;F原子半径比I原子小,H-F键比H-I键强,H-F更易形成,易夺取![]() 中的H+,所以NH4F、NH4I中,较易分解的是NH4F,故答案为:
中的H+,所以NH4F、NH4I中,较易分解的是NH4F,故答案为: ; CCl4;NH4F;
; CCl4;NH4F;
(4)①根据图示,晶胞中亚铁离子处于氧离子围成的正四面体空隙,故答案为:正四面体;
②根据图示,晶胞中氧离子的堆积方式为面心立方最密堆积,故答案为:面心立方最密堆积;
③含有自由移动电子的物质能导电,该晶体中含有亚铁离子和铁离子,电子可在两种不同价态的铁离子间快速发生转移,所以Fe3O4晶体能导电;该晶胞中氧离子个数=1+12×![]() =4,Fe元素的微粒个数=1+4×
=4,Fe元素的微粒个数=1+4×![]() +3×
+3×![]() =3,晶胞的质量=
=3,晶胞的质量=![]() g;晶胞的体对角线长度为anm,则晶胞棱长=
g;晶胞的体对角线长度为anm,则晶胞棱长=![]() nm=
nm=![]() nm,晶胞体积=(
nm,晶胞体积=(![]() ×10-7cm)3,则Fe3O4晶体的密度为
×10-7cm)3,则Fe3O4晶体的密度为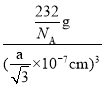 =
=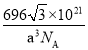 g/cm3,故答案为:电子可在两种不同价态的铁离子间快速发生转移;
g/cm3,故答案为:电子可在两种不同价态的铁离子间快速发生转移;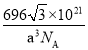 。
。

【题目】在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应 X(g)+Y(g) ![]() 2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:下列说法正确的是
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:下列说法正确的是
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.反应前2 min的平均速率v(Z)=2.0×10-3 mol/(L·min)
B.反应前2 min的平均速率v(Y)=4.0×10-3 mol/(L·min)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
【题目】高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g) ![]() 2Fe(s)+3CO2(g) △H
2Fe(s)+3CO2(g) △H
反应1: Fe2O3(s)+3C(石墨,s) ![]() 2Fe(s)+3CO(g) △H1
2Fe(s)+3CO(g) △H1
反应2: C(石墨,s)+CO2(g)![]() 2CO(g) △H2
2CO(g) △H2
①△H= _________(用含△H1、 △H2代数式表示)
②保持温度不变,在恒容容器中进行反应1,达到平衡状态,再次充入一定量的CO (Fe足量),则平衡_________移动(填“正向”或“逆向”),达到新平衡后c(CO)将_________(填“变大”、“变小”或“不变”)
(2)在T℃时,反应 Fe2O3(s)+3CO(g) ![]() 2Fe(s)+3CO2(g)的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
2Fe(s)+3CO2(g)的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
Fe2O3 | CO | Fe | CO2 | |
甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
①甲容器中CO的平衡转化率为_________
②下列说法正确的是_________(填字母)。
A.若容器压强恒定,说明反应达到平衡状态
B.增加Fe2O3的量能提高CO的转化率
C.甲容器中CO的平衡转化率大于乙的平衡转化率
D.若容器中固体质量不再改变,说明反应达到平衡状态
③取五等份CO,分别加入温度不同但容积相同的恒容密闭容器中(已装有足量Fe2O3),反应相同时间后,分别测定体系中CO的体积分数(CO%),并作出其随反应温度(T)变化的关系图,请在答题卡中作出平衡时混合气体的平均相对分子质量随反应温度(T)的变化示意图。
_________