题目内容
【题目】高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g) ![]() 2Fe(s)+3CO2(g) △H
2Fe(s)+3CO2(g) △H
反应1: Fe2O3(s)+3C(石墨,s) ![]() 2Fe(s)+3CO(g) △H1
2Fe(s)+3CO(g) △H1
反应2: C(石墨,s)+CO2(g)![]() 2CO(g) △H2
2CO(g) △H2
①△H= _________(用含△H1、 △H2代数式表示)
②保持温度不变,在恒容容器中进行反应1,达到平衡状态,再次充入一定量的CO (Fe足量),则平衡_________移动(填“正向”或“逆向”),达到新平衡后c(CO)将_________(填“变大”、“变小”或“不变”)
(2)在T℃时,反应 Fe2O3(s)+3CO(g) ![]() 2Fe(s)+3CO2(g)的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
2Fe(s)+3CO2(g)的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
Fe2O3 | CO | Fe | CO2 | |
甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
①甲容器中CO的平衡转化率为_________
②下列说法正确的是_________(填字母)。
A.若容器压强恒定,说明反应达到平衡状态
B.增加Fe2O3的量能提高CO的转化率
C.甲容器中CO的平衡转化率大于乙的平衡转化率
D.若容器中固体质量不再改变,说明反应达到平衡状态
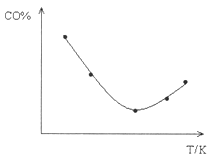
③取五等份CO,分别加入温度不同但容积相同的恒容密闭容器中(已装有足量Fe2O3),反应相同时间后,分别测定体系中CO的体积分数(CO%),并作出其随反应温度(T)变化的关系图,请在答题卡中作出平衡时混合气体的平均相对分子质量随反应温度(T)的变化示意图。
_________
【答案】 △H1-3△H2 逆向 不变 60% D 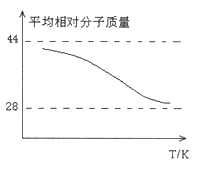
【解析】(1)①反应1:Fe2O3(s)+3C(石墨)![]() 2Fe(s)+3CO(g)△H1,反应2:C(石墨)+CO2(g)
2Fe(s)+3CO(g)△H1,反应2:C(石墨)+CO2(g)![]() 2CO(g)△H2,依据盖斯定律反应1-反应2×3得到Fe2O3(s)+3CO(g)
2CO(g)△H2,依据盖斯定律反应1-反应2×3得到Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)△H=△H1-3△H2,故答案为:△H1-3△H2;
2Fe(s)+3CO2(g)△H=△H1-3△H2,故答案为:△H1-3△H2;
②保持温度不变,在恒容容器中进行反应1,达到平衡状态,再次充入一定量的CO (Fe足量),CO的浓度增大,平衡逆向移动,温度不变,平衡常数不变,K= c3(CO),达到新平衡后c(CO)不变,故答案为:逆向;不变;
(2)①在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲中,加入物质反应达到平衡,设消耗一氧化碳物质的量为x
Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g)
起始量(mol) 1 1 1 1
变化量(mol) x x
平衡量(mol) 1-x 1+x
K=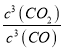 =
=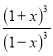 =64,计算得到x=0.6,转化率=60%,故答案为:60%;
=64,计算得到x=0.6,转化率=60%,故答案为:60%;
②A.若容器压强始终恒定,不能标志反应达到平衡状态,故A错误;B.固体量增加不影响化学平衡,增加Fe2O3不能提高CO的转化率,故B错误;C.乙容器中结合平衡常数计算得到消耗一氧化碳1mol,乙容器中CO的平衡转化率为66.6%,故C错误;D.若容器中固体质量不再改变,说明容器中其他物质的质量也不会改变,说明反应达到平衡状态,故D正确;故答案为:D;
③图中转折点为平衡状态,转折点左则为未平衡状态,右则为平衡状态,反应是放热反应,温度升高,平衡向逆反应方向移动,混合气体的平均相对分子质量逐渐减小,因此平衡时混合气体的平均相对分子质量随反应温度(T)的变化示意图为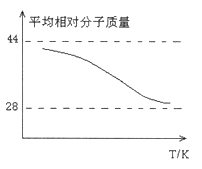 ,故答案为:
,故答案为: 。
。

 阅读快车系列答案
阅读快车系列答案