题目内容
【题目】在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应 X(g)+Y(g) ![]() 2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:下列说法正确的是
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:下列说法正确的是
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.反应前2 min的平均速率v(Z)=2.0×10-3 mol/(L·min)
B.反应前2 min的平均速率v(Y)=4.0×10-3 mol/(L·min)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
【答案】C
【解析】
A.前2min内v(Y)=![]() =2.0×10-3 mol/(Lmin),同一可逆反应中同一时间段内各物质的反应速率之比等于其计量数之比,据此计算v(Z);
=2.0×10-3 mol/(Lmin),同一可逆反应中同一时间段内各物质的反应速率之比等于其计量数之比,据此计算v(Z);
B.前2min内v(Y)=![]() =2.0×10-3 mol/(Lmin),同一可逆反应中同一时间段内各物质的反应速率之比等于其计量数之比,据此计算v(Y);
=2.0×10-3 mol/(Lmin),同一可逆反应中同一时间段内各物质的反应速率之比等于其计量数之比,据此计算v(Y);
C.反应到7min时,该反应达到平衡状态,根据方程式知,平衡时c(X)=c(Y)=0.10/10mol/L=0.01mol/L,c(Z)=0.16-0.10/10mol/L×2=0.012mol/L,化学平衡常数K=
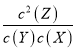 ;
;
D.该反应的正反应是放热反应,降低温度,平衡正向移动.
A. 前2min内v(Y)=![]() =2.0×10-3 mol/(Lmin),同一可逆反应中同一时间段内各物质的反应速率之比等于其计量数之比,则v(Z)=2v(X)=4.0×103mol/(Lmin),故A错误;
=2.0×10-3 mol/(Lmin),同一可逆反应中同一时间段内各物质的反应速率之比等于其计量数之比,则v(Z)=2v(X)=4.0×103mol/(Lmin),故A错误;
B. 前2min内v(Y)= ![]() =2.0×10-3 mol/(Lmin),同一可逆反应中同一时间段内各物质的反应速率之比等于其计量数之比,则v(Y)= v(X)=2.0×103mol/(Lmin),故B错误;
=2.0×10-3 mol/(Lmin),同一可逆反应中同一时间段内各物质的反应速率之比等于其计量数之比,则v(Y)= v(X)=2.0×103mol/(Lmin),故B错误;
C. 反应到7min时,该反应达到平衡状态,根据方程式知,平衡时c(X)=c(Y)=0.1010mol/L=0.01mol/L,,c(Z)=0.160.1010mol/L×2=0.012mol/L,化学平衡常数K=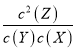 =
=![]() =1.44,故C正确;
=1.44,故C正确;
D. 该反应的正反应是放热反应,降低温度,平衡正向移动,则反应达到新平衡前v(逆)<v(正),故D错误;
故选C.