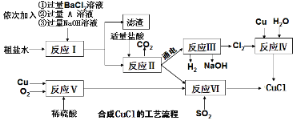
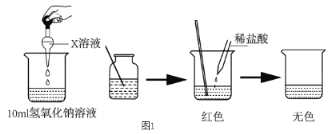
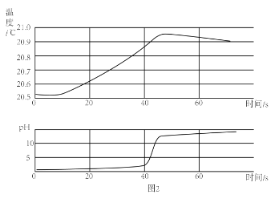
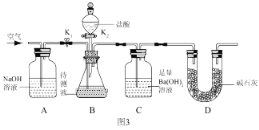
题目内容
【题目】下列说法中正确的是( )
①氢气在氯气中燃烧会发生爆炸 ②钠与硫酸铜溶液反应,可置换出铜 ③过氧化钠与水反应时可放出氧气④氯气与铁反应生成三氯化铁 ⑤钠、氢气都能在氯气中燃烧生成白雾 ⑥久置的氯水,因氯气几乎完全挥发掉,剩下的就是水
A. ③④ B. ①③⑤ C. ②④ D. ①④⑤
【答案】A
【解析】
①纯净的氢气在氯气中能安静的燃烧生成HCl ,故①说法不准确;②钠在硫酸铜溶液中发生的反应为:2Na+2H2O=2NaOH+H2↑,2NaOH+CuSO4 =Cu(OH)2↓+Na2SO4 ,不能置换出铜,故②说法错误;③过氧化钠与水反应:2Na2O2+2H2O=4NaOH+O2↑,故③正确;④氯气与铁反应:2Fe+3Cl2= 2FeCl3 ,故④正确;⑤钠在氯气中燃烧产生白烟,故⑤错误;⑥久置氯水中2HClO= 2HCl+O2↑,最后剩下的是稀盐酸,故⑥错误。故只有③④正确。
①纯净的氢气在氯气中能安静的燃烧生成HCl ,故①说法不准确;②钠在硫酸铜溶液中发生的反应为:2Na+2H2O=2NaOH+H2↑,2NaOH+CuSO4=Cu(OH)2↓+Na2SO4 ,不能置换出铜,故②说法错误;③过氧化钠与水反应:2Na2O2+2H2O=4NaOH+O2↑,故③正确;④氯气与铁反应:2Fe+3Cl2![]() 2FeCl3 ,故④正确;⑤钠在氯气中燃烧产生白烟,故⑤错误;⑥久置氯水中2HClO
2FeCl3 ,故④正确;⑤钠在氯气中燃烧产生白烟,故⑤错误;⑥久置氯水中2HClO ![]() 2HCl+O2↑,最后剩下的是稀盐酸,故⑥错误。故只有③④正确。A. ③④正确;B. ①③⑤不符合要求,故B错误;C. ②④不符合题意,故C错误; D. ①④⑤不符合题意,故D错误;本题答案为A。
2HCl+O2↑,最后剩下的是稀盐酸,故⑥错误。故只有③④正确。A. ③④正确;B. ①③⑤不符合要求,故B错误;C. ②④不符合题意,故C错误; D. ①④⑤不符合题意,故D错误;本题答案为A。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】二氧化硫分别通入下表所列溶液(装入试管)中至现象明显,如表实验报告记录的实验现象正确的是( )
石蕊试液 | 品红溶液 | 饱和硫化氢溶液 | 氯水 | |
A | 无色 | 无色 | 乳白色浑浊 | 无色 |
B | 红色 | 无色 | 黄色浑浊 | 无色 |
C | 红色 | 无色 | 乳白色浑浊 | 黄绿色 |
D | 无色 | 无色 | 乳白色浑浊 | 黄绿色 |
A.A
B.B
C.C
D.D
【题目】利用湿法炼锌产生的铜镉渣生产金属镉的流程如下:

已知:铜镉渣主要含锌、铜、铁、镉(Cd)、钴(Co)等单质。
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1 mol·L-1计算):
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 | Mn(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.2 | 8.2 |
沉淀完全的pH | 3.3 | 9.9 | 9.5 | 10.6 |
(1)为了提高铜镉渣浸出的速率,可采取的措施有:①适当升高温度;②搅拌;③______等。已知浸出的金属离子均为二价,写出浸出钴的化学方程式__________________。
(2)除钴的过程中,需要加入活化剂Sb2O3,锌粉会与Sb2O3、Co2+的溶液形成微电池并产生合金CoSb。该微电池的正极反应式为________________________________。
(3)除铁的过程分两步进行:
①先加入适量KMnO4,发生反应的离子方程式为______________________________,
②再加入ZnO控制反应液的pH范围为_____________。
(4)除铁过程第①步,若加入KMnO4时条件控制不当,MnO2会继续反应,造成的结果是______________,若加入的KMnO4不足量,则待电解溶液中有Fe元素残余。请设计实验方案加以验证_________________。
(5)净化后的溶液用惰性电极电解可获得镉单质。电解废液中可循环利用的溶质是____。
(6)处理含镉废水常用化学沉淀法,以下是几种镉的难溶化合物的溶度积常数(25℃):
Ksp(CdCO3)=5.210-12, Ksp(CdS)=3.610-29,Ksp(Cd(OH)2)=2.010-16,根据上述信息:
沉淀Cd2+效果最佳的试剂是____________。
a.Na2CO3 b.Na2S c.CaO
若采用生石灰处理含镉废水最佳pH为11,此时溶液中c(Cd2+)=_________。