题目内容
【题目】下列反应属于吸热反应的是( )
A.碳酸钙受热分解
B.氧化钙溶于水
C.甲烷燃烧
D.铝粉与盐酸反应
【答案】A
【解析】解:A.碳酸钙受热分解是吸热反应,故A正确;
B.氧化钙溶于水是放热反应,故B错误;
C.甲烷燃烧,发光发热,是放热反应,故C错误;
D.铝粉与盐酸反应是放热反应,故D错误;
故选A.
【考点精析】掌握吸热反应和放热反应是解答本题的根本,需要知道化学上把吸收热量的化学反应称为吸热反应;化学上把放出热量的化学反应称为放热反应.

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
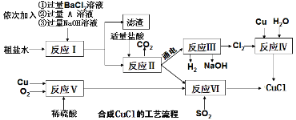
应用题点拨系列答案【题目】利用湿法炼锌产生的铜镉渣生产金属镉的流程如下:
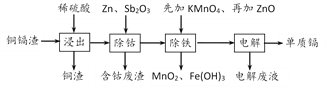
已知:铜镉渣主要含锌、铜、铁、镉(Cd)、钴(Co)等单质。
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1 mol·L-1计算):
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 | Mn(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.2 | 8.2 |
沉淀完全的pH | 3.3 | 9.9 | 9.5 | 10.6 |
(1)为了提高铜镉渣浸出的速率,可采取的措施有:①适当升高温度;②搅拌;③______等。已知浸出的金属离子均为二价,写出浸出钴的化学方程式__________________。
(2)除钴的过程中,需要加入活化剂Sb2O3,锌粉会与Sb2O3、Co2+的溶液形成微电池并产生合金CoSb。该微电池的正极反应式为________________________________。
(3)除铁的过程分两步进行:
①先加入适量KMnO4,发生反应的离子方程式为______________________________,
②再加入ZnO控制反应液的pH范围为_____________。
(4)除铁过程第①步,若加入KMnO4时条件控制不当,MnO2会继续反应,造成的结果是______________,若加入的KMnO4不足量,则待电解溶液中有Fe元素残余。请设计实验方案加以验证_________________。
(5)净化后的溶液用惰性电极电解可获得镉单质。电解废液中可循环利用的溶质是____。
(6)处理含镉废水常用化学沉淀法,以下是几种镉的难溶化合物的溶度积常数(25℃):
Ksp(CdCO3)=5.210-12, Ksp(CdS)=3.610-29,Ksp(Cd(OH)2)=2.010-16,根据上述信息:
沉淀Cd2+效果最佳的试剂是____________。
a.Na2CO3 b.Na2S c.CaO
若采用生石灰处理含镉废水最佳pH为11,此时溶液中c(Cd2+)=_________。
【题目】氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸。工业上用制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程如图所示:
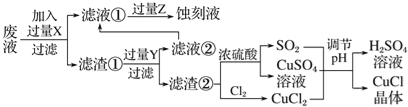
根据以上信息回答下列问题:
(1)写出生产过程中X________;Y________(填化学式)。
(2)析出的CuCl晶体不用水而用无水乙醇洗涤的目的是________________________;生产过程中调节溶液的pH不能过大的原因是________________________。
(3)写出生成CuCl的化学方程式:__________________________________。
(4)在CuCl的生成过程中理论上不需要补充SO2气体,其理由是_________________。
(5)已知:常温下Ksp(CuCl)=1.6×10-7,Ksp(CuI)=1.2×10-12,现向CuCl饱和溶液中加入NaI固体至c(I-)=0.1mol/L,此时溶液中c(Cu+)/c(Cl-)=________。
(6)氯化亚铜的定量分析
①称取样品0.25 g置于已放入10 mL过量的FeCl3溶液的锥形瓶中,不断摇动。
②待样品溶解后,加水50 mL,邻菲罗啉指示剂2滴。
③立即用0.10 mol·L-1硫酸铈标准溶液滴定至终点,同时做空白实验一次。
已知:
CuCl+FeCl3===CuCl2+FeCl2;Fe2++Ce4+===Fe3++Ce3+。
如此再重复2次测得:
1 | 2 | 3 | |
空白实验消耗硫酸铈 标准溶液的体积/mL | 0.75 | 0.50 | 0.80 |
0.25 g样品消耗硫酸铈 标准溶液的体积/mL | 24.65 | 25.75 | 24.90 |
④数据处理:计算得CuCl的纯度为_________(平行实验结果相差不能超过0.3%)。