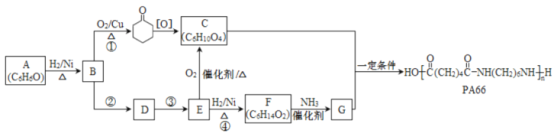
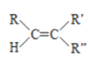
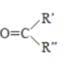
题目内容
【题目】下列“烧杯中的物质”和“向烧杯中分别加入的试剂”不能完成“实验目的”的是
① ②
② 
实验目的 | 烧杯中的物质 | 向烧杯中分别加入的试剂 | |
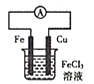
A | 醋酸的酸性强于苯酚 | ①醋酸 ②苯酚溶液 | 碳酸氢钠溶液 |
B | 羟基对苯环的活性有影响 | ①苯 ②苯酚溶液 | 饱和溴水 |
C | 甲基对苯环的活性有影响 | ①苯 ②甲苯 | 酸性高锰酸钾溶液 |
D | 乙醇羟基中的氢原子不如水分子中的氢原子活泼 | ①水 ②乙醇 | 金属钠 |
A.AB.BC.CD.D
【答案】C
【解析】
A.加入NaHCO3溶液,盛醋酸的烧杯中有气泡产生,盛苯酚溶液的烧杯中无现象,A不合题意;
B.苯酚溶液中加入饱和溴水,有白色沉淀生成,而苯中只发生萃取作用,B不合题意;
C.甲苯能使酸性高锰酸钾溶液褪色,表明苯环使甲基变得活泼,C符合题意;
D.金属钠与水反应比乙醇剧烈,表明水中氢原子比乙醇中活泼,D不合题意;
故选C。

 阅读快车系列答案
阅读快车系列答案【题目】铜锌银精矿化学成分如下:
元素 | Cu | Zn | Ag | S | Fe | Pb |
元素质量分数/% | 17.60 | 18.30 | 0.146 | 33.15 | 18.17 | 7.86 |
利用铜锌银精矿制备硫酸铜晶体的流程如下:

回答下列问题:
(l)“气体A”为____(填化学式),“浸渣”中主要为硫酸铅和____(填化学式)。
(2)“沉铜”得到Cu2Cl2固体,目的是____________。
(3)“氧化”工序中,恰好反应时氧化剂和还原剂物质的量之比为____。
(4)“母液2”中阴离子含量最多的是____,该溶液最好返回 __工序循环使用。
(5)依据铜锌银精矿化学成分进行分析,精矿中含有FeS2,理由是________。
【题目】Ⅰ.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
T(℃) | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K =_______。
(2)该反应为______反应(选填“吸热”、“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是_____。
a.容器中压强不变 b.υ正(H2)=υ逆(H2O)
c. c(CO2)=c(CO) d.混合气体中 c(CO)不变
(4) 830K时,各物质浓度符合下式:2c(CO2)·c(H2)=c(CO)·c(H2O),此时该反应 _______(填“正反应方向进行”、“逆反应方向进行”或“处于平衡状态”)。
Ⅱ.将1 mol I2(g) 和2 mol H2置于2 L密闭容器中,在一定温度下发生反应: I2(g) + H2(g) ![]() 2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
(1)若5分钟该达平衡,则用H2表示的反应速率为________。
(2)若改变反应条件,在甲条件下w(HI)的变化如曲线(Ⅰ) 所示,则甲条件可能是____。(填入下列条件的序号)
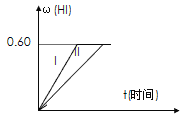
①恒温条件下,缩小反应容器体积;②恒温条件下,扩大反应容器体积;③恒容条件下,降低温度;④恒容条件下,升高温度;⑤恒温恒容条件下,加入适当催化剂。