题目内容
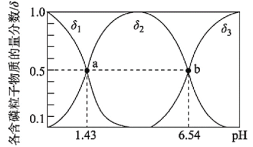
【题目】某课外研究小组设计数字化实验探究温度对盐类水解反应的影响。通过加热50mL 0.1000mol/L的Na2CO3标准溶液进行实验,测得溶液的pH随温度变化的关系如图所示,下列说法不正确的是
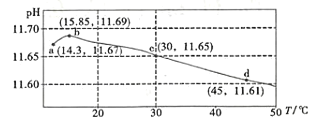
A.由ab段可得结论:CO32-(aq)+H2O(l)HCO3-(aq)+OH-(aq) H>0
B.e点溶液中:(OH- )=c(H+)+c( HCO3-)+2c( H2CO3)=1×10-3.35mol/L
C.bd段pH减小是水的Kw随着温度的升高而增大所致
D.从a→d随着温度升高,![]() 始终增大
始终增大
【答案】B
【解析】
A.观察ab小段图象变化可知,溶液的pH随着温度升高面增大,证明盐类的水解反应是吸热反应,该热化学方程式为CO32-(aq)+H2O(l)HCO3-(aq)+OH-(aq) H>0,故A正确;
B.由图可知e点溶液中:(OH- )=c(H+)+c( HCO3-)+2c(H2CO3),温度为30![]() ,所以不能用常温下的Kw进行相关计算,故B错误;
,所以不能用常温下的Kw进行相关计算,故B错误;
C.由图可知bd段pH随着温度的升高而逐渐减小,因为水的电离是吸热反应,随着温度,Kw增大,根据质子守恒规律,所以pH随着温度的升高而逐渐减小,故C正确;
D.因为水解是吸热反应,随着温度升高,盐类的水解程度增大,根据CO32-+H2OHCO3-+OH-、HCO3-+H2OH2CO3+OH-,所以从a→d随着温度升高,![]() 始终增大,故D正确;
始终增大,故D正确;
故答案:B。

【题目】下列“烧杯中的物质”和“向烧杯中分别加入的试剂”不能完成“实验目的”的是
① ②
② 
实验目的 | 烧杯中的物质 | 向烧杯中分别加入的试剂 | |
A | 醋酸的酸性强于苯酚 | ①醋酸 ②苯酚溶液 | 碳酸氢钠溶液 |
B | 羟基对苯环的活性有影响 | ①苯 ②苯酚溶液 | 饱和溴水 |
C | 甲基对苯环的活性有影响 | ①苯 ②甲苯 | 酸性高锰酸钾溶液 |
D | 乙醇羟基中的氢原子不如水分子中的氢原子活泼 | ①水 ②乙醇 | 金属钠 |
A.AB.BC.CD.D
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 用乙酸浸泡水壶中的水垢,可将其清除 | 乙酸的酸性小于碳酸 |
B | 将MgCl2溶液加热蒸干,得到白色固体 | 固体为MgCl2 |
C | 向某溶液中滴加K3[Fe(CN)6]溶液,产生蓝色沉淀 | 原溶液中有Fe2+ |
D | 向盛有1 mL 2 mol/L NaOH溶液的试管中滴入几滴0.1 mol/L MgCl2溶液,有白色沉淀生成;再加入几滴0.1 mol/L FeCl3溶液,有红褐色沉淀生成 | Ksp[Mg(OH)2] >Ksp[Fe(OH)3] |
A.AB.BC.CD.D