题目内容
【题目】一种以NH4Cl酸性蚀铜废液[含NH4Cl、Cu(NH3)4Cl2、CuCl、CuSO4及盐酸等]为原料制备CuCl并回收Cu(OH)2的工艺流程如图:

回答下列问题:
(1)“反应1”中,NaCl、Cu、CuSO4反应的离子方程式为____;生产中常将“过滤1”的滤渣返回到“反应1”中,其目的是______。
(2)“水解”步骤中,加入大量水稀释即可析出CuCl,原因是 ____________(结合离子方程式,从平衡角度分析)。
(3)湿的CuCl在空气中易被氧化为Cu2(OH)3Cl,该反应的化学方程式为____;“洗涤”时稀盐酸和乙醇洗涤的目的是______________ 。
(4)“反应2”需加入的试剂X是 ___;“吹脱”出来的NH3可用于生产碳铵化肥,主要反应的化学方程式为 ______ 。
(5)测定产品中CuCl质量分数的步骤如下:称取ag产品,加入稍过量的FeCl3溶液,待溶解后用邻非罗啉作指示剂,立刻用c mol/L的Ce(SO4)2标准溶液滴定到终点,消耗标准溶液VmL。则产品中CuCl的质量分数为____(已知滴定反应为 Ce4++Fe2+=Ce3++Fe3+,列出计算式)。
【答案】Cu+8Cl-+Cu2+=2CuCl43- 提高铜元素的利用率 uCl43-CuCl+3Cl-,稀释时平衡向粒子数增多的方向移动,即平衡右移 4CuCl+O2+4H2O=2Cu2(OH)3Cl+2HCl(或12CuCl+3O2+6H2O=4Cu2(OH)3Cl+4CuCl2) 稀盐酸抑制其氧化和水解,用乙醇洗涤可以促使其快速干燥 氢氧化钠(或其他合理答案) CO2+NH3+H2O=NH4HCO3 ![]() ×100%
×100%
【解析】
向废液中加入足量的铜和NaCl,将废液中的Cu2+转化为CuCl43-,过滤得到含有CuCl43-、SO42-、NH4+等离子的滤液,由于加入的铜足量,则滤渣中含有铜单质,向滤液中加入大量水稀释,使CuCl43-部分转化为CuCl晶体,对“水解”后的溶液过滤,分离出CuCl晶体,用盐酸和乙醇进行洗涤干燥,得到纯净的CuCl,向过滤后的溶液中加入足量氢氧化钠调节pH值,使剩余CuCl43-、NH4+分别转化为Cu(OH)2沉淀和一水合氨,过滤后可得Cu(OH)2,对滤液加热使一水合氨分解生成氨气并吹出,获得氨气,据此分析解答。
(1)“反应1”中,铜和NaCl,将废液中的铜离子转化为CuCl43-,离子方程式为Cu+8Cl-+Cu2+= 2CuCl43-;根据分析,滤渣中含有铜单质,生产中常将“过滤1”的滤渣返回到“反应1”中,可提高铜元素的利用率;
(2)“水解”步骤中,CuCl43-不稳定,可发生CuCl43-CuCl+3Cl-,加入大量水稀释,使溶液中离子浓度降低,促使平衡向粒子数增多的方向移动,即平衡右移,可析出CuCl;
(3)湿的CuCl在空气中易被氧化为Cu2(OH)3Cl,CuCl与水和氧气发生氧化还原反应,化学方程式为4CuCl+O2+4H2O=2Cu2(OH)3Cl+2HCl(或12CuCl+3O2+6H2O=4Cu2(OH)3Cl+4CuCl2);CuCl 不稳定易被氧化和水解,“洗涤”时稀盐酸可以防止CuCl氧化和水解,用乙醇洗涤可以使其快速干燥;
(4)根据分析,“反应2”需加入的试剂X是氢氧化钠;“吹脱”出来的NH3可用于生产碳铵化肥,碳铵化肥主要成分为碳酸氢铵,主要反应的化学方程式为CO2+NH3+H2O=NH4HCO3;
(5)CuCl加入稍过量的FeCl3溶液,三价铁具有氧化性可将亚铜氧化为2价铜,发生反应CuCl+Fe3+= Fe2++Cu2++Cl-,滴定时发生反应:Ce4++ Fe2+=Ce3++Fe3+,则转化关系为:CuCl~Fe2+~Ce4+~Ce(SO4)2,n(CuCl) = n[Ce(SO4)2]= cmol/L×V×10-3L=cV×10-3mol,则产品中CuCl的质量分数=![]() ×100%。
×100%。

【题目】H2S是石油化工行业广泛存在的污染性气体,但同时也是重要的氢源和硫源,工业上可以采取多种方式处理。
Ⅰ.干法脱硫
(1)已知H2S的燃烧热为akJmol-1 ,S的燃烧热为bkJmol-1 ,则常温下空气直接氧化脱除H2S的反应:2H2S(g)+O2(g)=2S(s)+2H2O(l) △H=______kJmol-1 。
(2)常用脱硫剂的脱硫效果及反应条件如下表,最佳脱硫剂为_________。
脱硫剂 | 出口硫(mg·m-3) | 脱硫温度(℃) | 操作压力(MPa) | 再生条件 |
一氧化碳 | <1.33 | 300~400 | 0~3.0 | 蒸气再生 |
活性炭 | <1.33 | 常温 | 0~3.0 | 蒸气再生 |
氧化锌 | <1.33 | 350~400 | 0~5.0 | 不再生 |
锰矿 | <3.99 | 400 | 0~2.0 | 不再生 |
Ⅱ.热分解法脱硫
在密闭容器中,充入一定量的H2S气体,发生热分解反应H2S(g)![]() 控制不同的温度和压强进行实验,结果如图(a)。
控制不同的温度和压强进行实验,结果如图(a)。
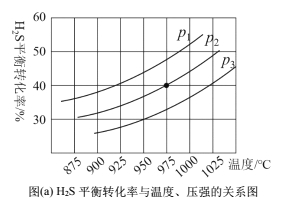
(3)图(a)中压强关系p1、p2、p3由大到小的顺序为______,该反应为____(填“吸热”或“放热”)反应,若要进一步提高H2S的平衡转化率,除了改变温度和压强外,还可以采取的措施有_______。
(4)压强为p、温度为975℃时,![]() 的平衡常数K=0.04,则起始浓度c=______molLˉ1,若向容器中再加入1molH2S气体,相同温度下再次达到平衡时,K_____0.04(填“>”1 “<”或“=”)。
的平衡常数K=0.04,则起始浓度c=______molLˉ1,若向容器中再加入1molH2S气体,相同温度下再次达到平衡时,K_____0.04(填“>”1 “<”或“=”)。
Ⅲ.间接电解法脱硫
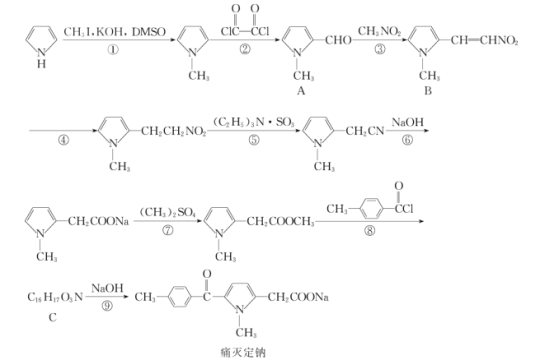
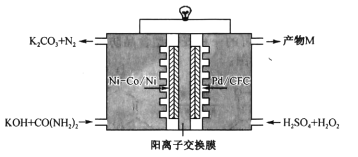
间接电解法是通过FeCl3溶液吸收并氧化H2S气体,将反应后溶液通过电解再生,实现循环使用,该法处理过程如下图(b)。
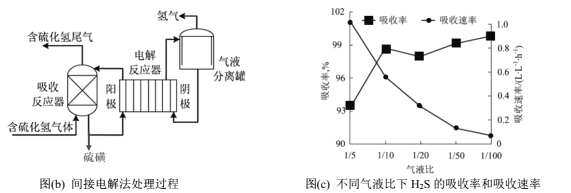
(5)电解反应器总反应的离子方程式为________。
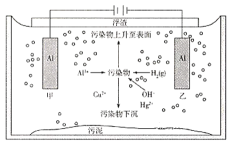
(6)气液比为气体与液体的流速比,吸收反应器内液体流速固定。测定吸收器中相同时间内不同气液比下H2S的吸收率和吸收速率,结果如图(c)所示,随着气液比减小,H2S的吸收速率逐渐降低,而吸收率呈上升趋势的原因为____________。
【题目】下列“烧杯中的物质”和“向烧杯中分别加入的试剂”不能完成“实验目的”的是
① ②
② 
实验目的 | 烧杯中的物质 | 向烧杯中分别加入的试剂 | |
A | 醋酸的酸性强于苯酚 | ①醋酸 ②苯酚溶液 | 碳酸氢钠溶液 |
B | 羟基对苯环的活性有影响 | ①苯 ②苯酚溶液 | 饱和溴水 |
C | 甲基对苯环的活性有影响 | ①苯 ②甲苯 | 酸性高锰酸钾溶液 |
D | 乙醇羟基中的氢原子不如水分子中的氢原子活泼 | ①水 ②乙醇 | 金属钠 |
A.AB.BC.CD.D