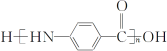
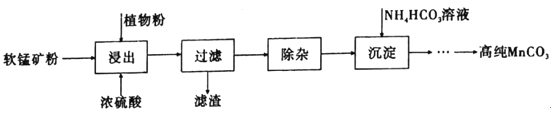
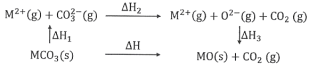
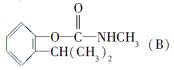��Ŀ����
����Ŀ��ij�����ܱ������г���һ����SO2��O2���з�Ӧ�� 2SO2(g)��O2(g)![]() 2SO3(g) ��H<0��ͼ�ױ�ʾ��Ӧ����(v)���¶�(T) �Ĺ�ϵ��ͼ�ұ�ʾ T1 ʱ��ƽ����ϵ��SO2�����������ѹǿ(p)�Ĺ�ϵ������˵����ȷ���ǣ� ��
2SO3(g) ��H<0��ͼ�ױ�ʾ��Ӧ����(v)���¶�(T) �Ĺ�ϵ��ͼ�ұ�ʾ T1 ʱ��ƽ����ϵ��SO2�����������ѹǿ(p)�Ĺ�ϵ������˵����ȷ���ǣ� ��
ͼ�� ��ͼ��
��ͼ��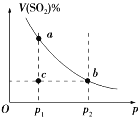
A.ͼ���У�����1��ʾ����Ӧ�������¶ȵĹ�ϵ
B.ͼ���У�a��b����ķ�Ӧ���ʣ�v(a)>v(b)
C.ͼ���У�d��ʱ����������ƽ��Ħ���������ٸı�
D.ͼ���У�c��������淴Ӧ���ʣ�v(��) < v(��)
���𰸡�C
��������
A����Ӧ2SO2(g)+O2(g)2SO3(g)��H��0������Ӧ���ȣ������¶ȣ�ƽ�������ƶ����淴Ӧ���ʴ�������Ӧ���ʣ�������1��ʾ�淴Ӧ�������¶ȵĹ�ϵ����A����
B���¶Ⱥ㶨ʱ��a��b�����Ӧ��ѹǿ��b�Ĵ�ѹǿԽ��Ӧ����Խ�죬a��b�����Ӧ�ķ�Ӧ���ʣ�va��vb����B����
C��d���ʾ�¶�ΪT0ʱ�������淴Ӧ������ȣ�˵����Ӧ�ﵽƽ�⣬���������ƽ��Ħ���������ٸı䣬��C��ȷ��
D��c��ʱ����������ĺ���С��ƽ��ʱ�ĺ�������Ӧ��Ҫ�����ɶ�������ķ�����У������淴Ӧ������У�����v(��)��v(��)����D����
��ѡC��

����Ŀ����.��һ��������ܱ������У��������»�ѧ��Ӧ��CO2(g)��H2(g)![]() CO(g)��H2O(g)���仯ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���
CO(g)��H2O(g)���仯ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���
T������ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�ش��������⣺
(1)�÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK ��_______��
(2)�÷�ӦΪ______��Ӧ��ѡ������������������������
(3)���жϸ÷�Ӧ�Ƿ�ﵽ��ѧƽ��״̬��������_____��
a��������ѹǿ���� b��������H2����������H2O��
c�� c��CO2����c��CO�� d����������� c��CO������
(4) 830Kʱ��������Ũ�ȷ�����ʽ��2c��CO2����c��H2����c��CO����c��H2O������ʱ�÷�Ӧ _______����������Ӧ��������������淴Ӧ�����������������ƽ��״̬������
��.��1 mol I2(g) ��2 mol H2����2 L�ܱ������У���һ���¶��·�����Ӧ�� I2(g) + H2(g) ![]() 2HI(g)����H��0������ƽ�⡣HI���������w(HI)��ʱ��仯��ͼ����(��)��ʾ��
2HI(g)����H��0������ƽ�⡣HI���������w(HI)��ʱ��仯��ͼ����(��)��ʾ��
(1)��5���Ӹô�ƽ�⣬����H2��ʾ�ķ�Ӧ����Ϊ________��
(2)���ı䷴Ӧ�������ڼ�������w(HI)�ı仯������(��) ��ʾ���������������____��������������������ţ�
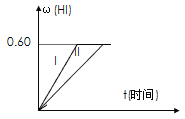
�����������£���С��Ӧ��������������������£�����Ӧ��������������������£������¶ȣ������������£������¶ȣ������º��������£������ʵ�������
����Ŀ����ѧ�ڿɳ�����չ����Դ���ۺ����������˾��ס�ú��ʯ�͡���Ȼ����Щ��ʯ��Դ��θ��õ��ۺ����ã���ؼ���������죬��ش��������⣺
��1����ˮú������Ҫ��ѧ��Ӧ����ʽΪ��C(s)+H2O(g)![]() CO(g)+H2(g)���˷�Ӧ�����ȷ�Ӧ��
CO(g)+H2(g)���˷�Ӧ�����ȷ�Ӧ��
�ٴ˷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ___��
������������̼��ת���ʵĴ�ʩ��___��(��д��Ӧ��ĸ)
A������C(s) B������H2O(g) C�������¶� D������ѹǿ
��2����֪����ӦFe(s)��CO2(g)![]() FeO(s)��CO(g)��ƽ�ⳣ��ΪK1����ӦFe(s)��H2O(g)
FeO(s)��CO(g)��ƽ�ⳣ��ΪK1����ӦFe(s)��H2O(g)![]() FeO(s)��H2(g)��ƽ�ⳣ��ΪK2����ͬ�¶�ʱK1��K2��ֵ���±���
FeO(s)��H2(g)��ƽ�ⳣ��ΪK2����ͬ�¶�ʱK1��K2��ֵ���±���
�¶�/K | K1 | K2 |
973 | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
���ݱ������ݣ�
�ټ��㷴ӦCO2(g)��H2(g)![]() CO(g)��H2O(g) �¶���973 Kʱ��K��__��(�������С�����2λ)
CO(g)��H2O(g) �¶���973 Kʱ��K��__��(�������С�����2λ)
�ڷ�ӦCO2(g)��H2(g)![]() CO(g)��H2O(g)��___(����ȡ����ȡ�)��Ӧ��
CO(g)��H2O(g)��___(����ȡ����ȡ�)��Ӧ��
����֪���¶�ΪTʱ��CO(g)��H2O(g)![]() CO2(g)��H2(g)��ƽ�ⳣ��K��0.32���ڸ��¶��£���֪cʼ(CO)��1mol��L��1��cʼ(H2O)��1mol��L��1��ijʱ�̾��ⶨCO��ת����Ϊ10%����÷�Ӧ__(��Ѿ�����û�С�)�ﵽƽ�⣬��ʱ��v��___v��(���������������=��)��
CO2(g)��H2(g)��ƽ�ⳣ��K��0.32���ڸ��¶��£���֪cʼ(CO)��1mol��L��1��cʼ(H2O)��1mol��L��1��ijʱ�̾��ⶨCO��ת����Ϊ10%����÷�Ӧ__(��Ѿ�����û�С�)�ﵽƽ�⣬��ʱ��v��___v��(���������������=��)��