题目内容
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是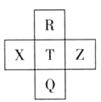
| A.非金属性:Z<T<X |
| B.R与Q的电子数相差26 |
| C.气态氢化物稳定性:R <T<Q |
| D.最高价氧化物的水化物的酸性: X > T |
B
解析试题分析:根据元素的构、位、性的关系,结合题意可推知这几种元素分别是R:F;X:S;T:Cl; Z: Ar; Q: Br.A元素的非金属性:T>X,错误。B.R是9号元素,Q是35号元素二者的电子数的差是26。正确。C.同族元素,从上到下,元素的原子半径逐渐增大,元素的非金属性逐渐减弱,对应气态氢化物稳定性逐渐减弱。所以:气态氢化物稳定性:R>T>Q。 错误。D.在同一周期中,从左向右,随着原子序数的增大,元素的非金属性逐渐减弱,金属性逐渐增强。元素对应的最高价氧化物的水化物的酸性逐渐减弱。所以:最高价氧化物的水化物的酸性:T > X。错误。
考点:考查元素周期表、元素周期律的知识。

 优生乐园系列答案
优生乐园系列答案A元素的阳离子与B元素的阴离子具有相同的电子层结构,有关两元素的下列叙述:
①原子半径A<B;②离子半径A>B;③原子序数A>B;④原子最外层电子数A<B;⑤A 的正价与B的负价绝对值一定相等;⑥A的电负性小于B的电负性;⑦A的第一电离能大于B的第一电离能。其中正确的组合是
| A.①②⑦ | B.③④⑥ | C.③⑤ | D.③④⑤⑥⑦ |
下列顺序不正确的是
| A.热稳定性:HF > HCl > HBr > HI |
| B.微粒的半径:Cl-> Na+> Mg2+> Al3+ |
| C.电离程度(同温度同浓度溶液中):HCl > CH3COOH > NaHCO3 |
| D.分散质粒子的直径:Fe(OH)3悬浊液 > Fe(OH)3胶体 > FeCl3溶液 |
2013年2月朝鲜进行了第三次核试验,引起国际社会的极大关注。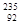 U是一种重要的核燃料,这里的“235”是指该原子的
U是一种重要的核燃料,这里的“235”是指该原子的
| A.质子数 | B.中子数 | C.电子数 | D.质量数 |
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中Z的一种氧化物能使品红溶液褪色,则下列说法正确的是( )
| A.非金属性:R<T<Q | B.T与Q的电子数相差18 |
| C.原子半径:R< T< Z | D.X的氧化物既能与盐酸反应又能与氢氧化钠溶液反应 |
短周期元素R、T、Q、W在元素周期表中的相对位置如下图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是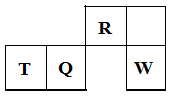
| A.最简单气态氢化物的热稳定性:R>Q |
| B.最高价氧化物对应水化物的酸性:Q<W |
| C.原子半径:T>Q>R |
| D.含T的盐溶液一定显示酸性 |
据报道,美国夏威夷联合天文中心的科学家发现了一种新型氢粒子,这种粒子是由3个氢原子核(只有质子)和2个电子构成。对于这种粒子,下列说法中正确的是( )
| A.是氢的一种新的单质 | B.是氢的一种新的同位素 |
| C.它的组成可用H3表示 | D.它比一个普通H2分子多一个氢原子核 |
元素性质的周期性变化不包括
| A.原子半径 | B.化合价 | C.原子核外电子结构 | D.金属性和非金属性 |