题目内容
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中Z的一种氧化物能使品红溶液褪色,则下列说法正确的是( )
| A.非金属性:R<T<Q | B.T与Q的电子数相差18 |
| C.原子半径:R< T< Z | D.X的氧化物既能与盐酸反应又能与氢氧化钠溶液反应 |
B
解析试题分析:根据已知条件能使品红溶液褪色的氧化物熟悉的为SO2,所以Z为S硫元素,则可推X、R、T、Q分别为Si、N、P、As等元素,根据元素周期律非金属性N>P>As,A错误;P元素在第三周期,As在第四周期,它们相差18个元素,所以相差18个电子,B正确;原子半径R<Z<T,所以C错误;X的氧化物为SiO2,它只能与唯一的酸氢氟酸反应,所以D错误。
考点:本题考查的是元素周期表和元素周期律的知识。

练习册系列答案
相关题目
2011年3月11日,日本大地震引起全世界关注,中国核事故应急协调委员会4月1曰发布,内地除西藏外都检测到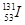 ,还检测到了极微量的人工放射性核素
,还检测到了极微量的人工放射性核素 、
、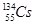 。已知铯(Cs)是钠的同族元素,据此,下列关说法正确的是( )
。已知铯(Cs)是钠的同族元素,据此,下列关说法正确的是( )
A. 、 、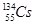 互为同位素 互为同位素 |
B.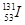 放出射线是一个自发的化学变化过程,射线对人危害很大 放出射线是一个自发的化学变化过程,射线对人危害很大 |
C.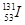 与 与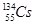 的中子数相同 的中子数相同 |
| D.单质铯的金属性比单质钠弱 |
下列有关物质结构和性质的说法中,正确的是( )
| A.因为水溶液的酸性:HCl>H2S,所以非金属性:Cl>S |
| B.同周期第ⅡA族与第IIIA族的元素原子序数之差不一定为1 |
| C.元素原子的最外层电子数越多,越容易得电子,非金属性越强 |
| D.同周期主族元素的原子形成的简单离子电子层结构相同 |
下列具有特殊性能的材料中,由主族元素和副族元素形成的化合物是
| A.半导体材料砷化镓 | B.透明陶瓷材料硒化锌 |
| C.吸氢材料镧镍合金 | D.超导材料K3C60 |
下列说法正确的是 ( )
A.Na的结构示意图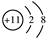 |
| B.多电子原子中,在离核较远区域运动的电子能量较低 |
| C.非金属元素组成的化合物中可能有共价键和离子键 |
| D.HF、HCl、HBr、HI的热稳定性和还原性依次增强 |
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是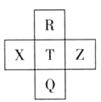
| A.非金属性:Z<T<X |
| B.R与Q的电子数相差26 |
| C.气态氢化物稳定性:R <T<Q |
| D.最高价氧化物的水化物的酸性: X > T |
X、Y、Z、R、W是5种短周期元素,原子序数依次增大,它们可组成离子化合物Z2Y和共价化合物RY3、XW4,已知Y、R同主族,Z、R、W同周期。下列说法不正确的是( )
| A.原子半径:Z>R>W |
| B.XW4分子中各原子均满足8电子结构 |
| C.气态氢化物的稳定性:HmW>HnR |
| D.Y、Z形成的化合物中只可能存在离子键 |
下列叙述中,可以肯定是一种主族金属元素的是 ( )
| A.原子最外层有3个电子的一种金属 |
| B.熔点低于100℃的一种金属 |
| C.次外电子层上有8个电子的一种元素 |
| D.除最外层,原子的其他电子层电子数目均达饱和的一种金属 |
