题目内容
元素性质的周期性变化不包括
| A.原子半径 | B.化合价 | C.原子核外电子结构 | D.金属性和非金属性 |
C
解析试题分析:周期律中元素的性质指的是原子半径、元素主要化合价、元素的金属性和非金属性等,原子核外电子排布的周期性变化是元素周期律的实质。
考点:考查元素周期律内容。

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是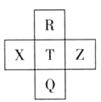
| A.非金属性:Z<T<X |
| B.R与Q的电子数相差26 |
| C.气态氢化物稳定性:R <T<Q |
| D.最高价氧化物的水化物的酸性: X > T |
科学家用氘盐酸(DCl)和重水(D2O)溶液处理样品,对收集的气体加以分析,结果只发现有一些气体状态的碳氘化合物。这个实验不能用普通盐酸,其理由是( )
| A.普通盐酸的酸性太强 |
| B.普通盐酸具有挥发性 |
| C.普通盐酸和月球岩石中的碳化物无法反应 |
| D.无法区别岩石中原来含有的是含碳而不含普通氢的化合物,还是含碳和普通氢的化合物 |
现行元素周期表中已列出112种元素,其中元素种类最多的周期是 ( )
| A.第四周期 | B.第五周期 | C.第六周期 | D.第七周期 |
下列叙述中,可以肯定是一种主族金属元素的是 ( )
| A.原子最外层有3个电子的一种金属 |
| B.熔点低于100℃的一种金属 |
| C.次外电子层上有8个电子的一种元素 |
| D.除最外层,原子的其他电子层电子数目均达饱和的一种金属 |
五种短周期元素的某些性质如表所示(其中只有W、Y、Z为同周期元素)。
| 元素代号 | X | W | Y | Z | Q |
| 原子半径(×10-12 m) | 37 | 64 | 66 | 70 | 154 |
| 主要化合价 | +1 | -1 | -2 | +5、-3 | +1 |
下列说法正确的是
A.由Q与Y形成的化合物中只存在离子键
Z与X之间形成的化合物具有还原性
C.由X、Y、Z三种元素形成的化合物,其晶体一定是分子晶体
D.Y与W形成的化合物中,Y显负价
下列说法正确的是(其中NA表示阿伏加德罗常数)
| A.质子数相等、中子数不等的微粒一定属于同位素 |
| B.比黄金还贵的18O2和普通的16O2是两种不同的核素 |
| C.常温常压下,0.1molD216O中含中子数、质子数、电子数均为NA |
| D.对人体有害元素氡的放射性同位素22286Rn,其原子中的质子数为136 |
下图是第三周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是
| A.y轴表示的可能是第一电离能 |
| B.y轴表示的可能是电负性 |
| C.y轴表示的可能是原子半径 |
| D.y轴表示的可能是形成基态离子转移的电子数 |
图中a、b、c、d、e、f为元素周期表中前4周期的一部分元素,下列有关叙述正确的是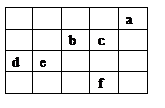
| A.b、c、e三种元素的原子半径大小关系:e>c>b |
| B.六种元素分别形成的单质固体中,d的熔、沸点最高 |
| C.c的氢化物沸点比f的氢化物沸点低 |
| D.b元素除0价外,只有一种化合价 |