题目内容
据报道,美国夏威夷联合天文中心的科学家发现了一种新型氢粒子,这种粒子是由3个氢原子核(只有质子)和2个电子构成。对于这种粒子,下列说法中正确的是( )
| A.是氢的一种新的单质 | B.是氢的一种新的同位素 |
| C.它的组成可用H3表示 | D.它比一个普通H2分子多一个氢原子核 |
D
解析试题分析:这种粒子是由3个氢原子核(只有质子)和2个电子构成,为H3+,为阳离子,所以A、B、C错误;H3+比H2分子多一个氢原子核,故D项正确。
考点:本题考查化学基本概念和原子结构。

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是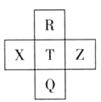
| A.非金属性:Z<T<X |
| B.R与Q的电子数相差26 |
| C.气态氢化物稳定性:R <T<Q |
| D.最高价氧化物的水化物的酸性: X > T |
X、Y、Z、R、W是5种短周期元素,原子序数依次增大,它们可组成离子化合物Z2Y和共价化合物RY3、XW4,已知Y、R同主族,Z、R、W同周期。下列说法不正确的是( )
| A.原子半径:Z>R>W |
| B.XW4分子中各原子均满足8电子结构 |
| C.气态氢化物的稳定性:HmW>HnR |
| D.Y、Z形成的化合物中只可能存在离子键 |
2010年3月30日,我国研究人员发表报告认为,全球将有1.4亿人因为用水而受到砷中毒之害、导致更多的人患癌症。海带含砷超标,经水浸泡24小时后,其含砷量才能达到食用安全标准。下列对砷(As)的有关判断正确的是 ( )
| A.砷原子序数为33,第4周期第5A族 | B.砷酸化学式为H2AsO4 |
| C.砷化氢的稳定性比溴化氢的强 | D.砷酸的酸性比硫酸的弱 |
科学家用氘盐酸(DCl)和重水(D2O)溶液处理样品,对收集的气体加以分析,结果只发现有一些气体状态的碳氘化合物。这个实验不能用普通盐酸,其理由是( )
| A.普通盐酸的酸性太强 |
| B.普通盐酸具有挥发性 |
| C.普通盐酸和月球岩石中的碳化物无法反应 |
| D.无法区别岩石中原来含有的是含碳而不含普通氢的化合物,还是含碳和普通氢的化合物 |
现行元素周期表中已列出112种元素,其中元素种类最多的周期是 ( )
| A.第四周期 | B.第五周期 | C.第六周期 | D.第七周期 |
下图是第三周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是
| A.y轴表示的可能是第一电离能 |
| B.y轴表示的可能是电负性 |
| C.y轴表示的可能是原子半径 |
| D.y轴表示的可能是形成基态离子转移的电子数 |