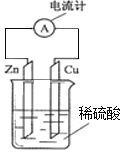
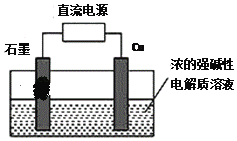
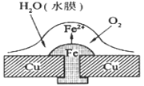
题目内容
【题目】某学生用邻苯二甲酸氢钾,(分子式为![]() 相对分子质量为204)测定NaOH溶液的浓度,若NaOH溶液的浓度在0.1mol/L左右,滴定终点时溶液的pH约为9.1。
相对分子质量为204)测定NaOH溶液的浓度,若NaOH溶液的浓度在0.1mol/L左右,滴定终点时溶液的pH约为9.1。
(1)写出邻苯二甲酸氢钾与NaOH反应的化学方程式:________。
(2)将用分析天平精确称量的邻苯二甲酸氢钾放于锥形瓶中,加适量的水溶解,溶液无色,再加入指示剂_____(从甲基橙、酚酞、石蕊中选择),用NaOH溶液滴定到终点时,现象是________。
(3)该实验要用到的主要玻璃仪器_______、______。
(4)该学生进行三次实验,所取固体的质量均相同,填写下表:
实验 编号 | 邻苯二甲酸氢钾的质量(g) | 待测NaOH溶液的体积(mL) |
1 | 0.4488 | 22.24 |
2 | 20.04 | |
3 | 19.96 |
滴定中误差较大的是第_____次实验,造成这种误差的可能原因是_____
a.滴定时有NaOH溶液滴到锥形瓶外面;
b.未用NaOH溶液润洗滴定管;
c.NaOH溶液在“0”刻度线以上,未予调整就开始滴定;
d.观察记录滴定管内液面刻度时滴定前仰视,滴定后俯视;
e.酚酞指示剂由无色变为红色时立即停止滴定。
(5)NaOH溶液的物质的量浓度为______。
【答案】![]() +NaOH
+NaOH![]()
![]() +H2O 酚酞 无色溶液变成浅红色,且半分钟内不褪色 碱式滴定管 锥形瓶 1 ab 0.11mol/L
+H2O 酚酞 无色溶液变成浅红色,且半分钟内不褪色 碱式滴定管 锥形瓶 1 ab 0.11mol/L
【解析】
(1)邻苯二甲酸氢钾与NaOH生成邻苯二甲酸钠钾和水;
(2)根据滴定终点的pH要在指示剂的变色范围之内确定指示剂;根据指示剂在不同的酸碱性溶液显示不同的颜色判断滴定终点;
(3)根据实验操作分析仪器;
(4)根据表中数据分析,第一次操作与另外两次数据差别较大;根据实验操作分析误差;
(5)邻苯二甲酸氢钾的质量求出物质的量,进一步计算NaOH物质的量,结合体积求出浓度。
(1)邻苯二甲酸氢钾与NaOH生成邻苯二甲酸钠钾和水,其反应方程为:![]() +NaOH
+NaOH![]()
![]() +H2O;
+H2O;
(2)滴定终点时溶液的pH约为9.1,滴定终点的pH要在指示剂的变色范围之内,所以选用酚酞作指示剂,酚酞在pH<8时为无色,pH为8~10之间,呈浅红色,所以当无色溶液变成浅红色,且半分钟内不褪色,说明反应到终点;
(3)该实验要用碱式滴定管盛放氢氧化钠溶液,用锥形瓶盛放邻苯二甲酸氢钾,故主要玻璃仪器为:碱式滴定管、锥形瓶;
(4)根据表中数据分析,第1次操作与另外两次数据差别较大,且第1次所耗NaOH溶液体积偏大;
a.滴定时有NaOH溶液滴到锥形瓶外面,导致消耗的NaOH溶液体积偏大,故a正确;
b.未用NaOH溶液润洗滴定管,NaOH溶液的浓度偏小,导致消耗NaOH溶液体积偏大,故b正确;
c.NaOH溶液在“0”刻度线以上,未予调整就开始滴定,滴定终点后读数偏小,导致消耗NaOH溶液体积偏小,故c错误;
d.观察记录滴定管内液面刻度时滴定前仰视,滴定后俯视,读数偏小,导致消耗NaOH溶液体积偏小,故d错误;
e.酚酞指示剂由无色变为红色时立即停止滴定,未振荡后观察溶液颜色,可能会导致耗NaOH溶液体积偏小,故e错误;
故答案为ab;
(5)邻苯二甲酸氢钾,分子内有1个羧基,所以邻苯二甲酸氢钾与氢氧化钠按1:1反应,即邻苯二甲酸氢钾与氢氧化钠的物质的量相等,n(邻苯二甲酸氢钾)=![]() =0.4488g÷204g/mol=0.0022mol,V(NaOH)=
=0.4488g÷204g/mol=0.0022mol,V(NaOH)=![]() ×10-3L=0.020L,所以氢氧化钠溶液物质的量浓度为c(NaOH)=
×10-3L=0.020L,所以氢氧化钠溶液物质的量浓度为c(NaOH)=![]() =
=![]() =0.11mol/L。
=0.11mol/L。

【题目】NiCl2是化工合成中最重要的镍源。工业上利用含镍(Ni)废催化剂(主要含有Ni,还含有SiO2、Al2O3、Fe及其它不溶于酸、碱的杂质)生产氯化镍晶体(NiCl2·nH2O)流程如图:
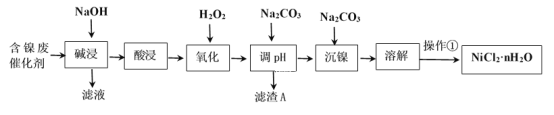
部分金属氢氧化物Ksp近似值如下表所示:
化学式 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 |
Ksp近似值 | 10-17 | 10-38 | 10-34 | 10-15 |
回答下列问题:
(1)Al的原子结构示意图为___。
(2)“酸浸”、“溶解”所使用的酸为___。“碱浸”时发生反应的离子方程式为SiO2+2OH-=SiO32-+H2O、____。
(3)“氧化”加入H2O2溶液,其作用是___(用离子方程式表示)。然后调节pH使溶液中铁元素恰好完全沉淀(离子浓度≤10-5mol·L-1时,离子沉淀完全),此时常温下的pH约为____。
(4)“操作①”的实验操作依次为缓缓加热,浓缩至___为止、冷却结晶、过滤、洗涤、干燥,即得产品。
(5)镍氢电池已成为混合动力汽车的主要电池类型,其在碱性电解质溶液的工作原理如下:M+Ni(OH)2![]() MH+NiOOH(式中M为储氢合金)。写出电池充电过程中阳极的电极反应式___。
MH+NiOOH(式中M为储氢合金)。写出电池充电过程中阳极的电极反应式___。