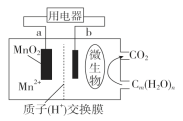
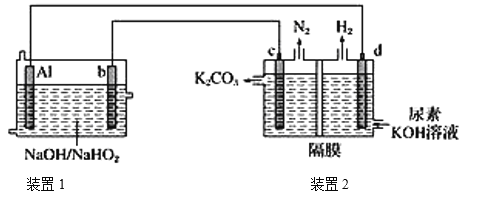
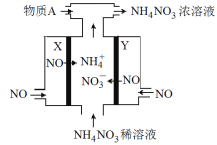
题目内容
【题目】(1)CO还原脱硝技术可有效降低烟气中的NOx的排放量。回答下列问题:
CO还原NO的脱硝反应:2CO(g)+2NO(g)2CO2(g)+N2(g) △H
已知:CO(g)+NO2(g)CO2(g)+NO(g) △H1=—226kJmol—1
N2(g)+2O2(g)2NO2(g) △H2=+68kJmol—1
N2(g)+O2(g)2NO(g) △H3=+183kJmol—1
脱硝反应△H=______,该反应向正反应方向自发进行的倾向很大,其原因是_______,有利于提高NO平衡转化率的条件是(写出两条)________、___________。
(2)直接供氨式燃料电池是以NaOH溶液为电解质的.电池反应为:4NH3+3O2=2N2+6H2O,则负极电极反应式为_________。
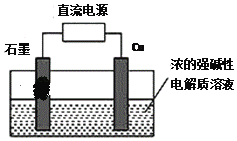
(3)用甲醇燃料电池作为直流电源,设计如图装置制取Cu2O,电解总反应为:2Cu+H2O=Cu2O+H2↑。写出阳极的电极反应式_______。
【答案】-750kJ/mol 该反应为放热量大的反应 降温 升压或增大CO和NO的投料比等 NH3+6OH--6e-=N2+6H2O 2Cu+2OH--2e-=Cu2O+H2O
【解析】
(1)已知:①CO(g)+NO2(g)CO2(g)+NO(g)△H1=-226kJmol-1,②N2(g)+2O2(g)2NO2(g)△H2=+68kJmol-1,③N2(g)+O2(g)2NO(g)△H3=+183kJmol-1,盖斯定律计算①×2+②-③×2得到2CO(g)+2NO(g)2CO2(g)+N2(g)△H;该反应向正反应方向自发进行的倾向很大,说明反应放热多,根据外界条件对化学平衡的影响分析有利于提高NO 平衡转化率的方法;
(2)根据原电池工作原理及电极反应写出该燃料电池的负极反应式;
(3)由总的反应式2Cu+H2O=Cu2O+H2↑可知:铜的化合价升高,被氧化,是电解池的阳极,铜最后生成氧化亚铜,由此写出阳极电极反应式。
(1)已知:①CO(g)+NO2(g)CO2(g)+NO(g)△H1=-226kJmol-1,②N2(g)+2O2(g)2NO2(g)△H2=+68kJmol-1,③N2(g)+O2(g)2NO(g)△H3=+183kJmol-1,盖斯定律计算①×2+②-③×2得到2CO(g)+2NO(g)2CO2(g)+N2(g)△H=-750kJ/mol;该反应向正反应方向自发进行的倾向很大,其原因是该反应为放热量大的反应,反应为气体体积减小的放热反应,有利于提高NO 平衡转化率的条件是:降温、升压、增大CO和NO的投料比等;
(2)原电池负极失去电子发生氧化反应,所以该燃料电池中负极氨气失去电子生成氮气,电极反应式为2NH3+6OH--6e-=N2+6H2O;
(3)由总的反应式2Cu+H2O=Cu2O+H2↑可知:铜的化合价升高,被氧化,是电解池的阳极,电极反应式为:2Cu+2OH--2e-=Cu2O+H2O。

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案【题目】某学生用邻苯二甲酸氢钾,(分子式为![]() 相对分子质量为204)测定NaOH溶液的浓度,若NaOH溶液的浓度在0.1mol/L左右,滴定终点时溶液的pH约为9.1。
相对分子质量为204)测定NaOH溶液的浓度,若NaOH溶液的浓度在0.1mol/L左右,滴定终点时溶液的pH约为9.1。
(1)写出邻苯二甲酸氢钾与NaOH反应的化学方程式:________。
(2)将用分析天平精确称量的邻苯二甲酸氢钾放于锥形瓶中,加适量的水溶解,溶液无色,再加入指示剂_____(从甲基橙、酚酞、石蕊中选择),用NaOH溶液滴定到终点时,现象是________。
(3)该实验要用到的主要玻璃仪器_______、______。
(4)该学生进行三次实验,所取固体的质量均相同,填写下表:
实验 编号 | 邻苯二甲酸氢钾的质量(g) | 待测NaOH溶液的体积(mL) |
1 | 0.4488 | 22.24 |
2 | 20.04 | |
3 | 19.96 |
滴定中误差较大的是第_____次实验,造成这种误差的可能原因是_____
a.滴定时有NaOH溶液滴到锥形瓶外面;
b.未用NaOH溶液润洗滴定管;
c.NaOH溶液在“0”刻度线以上,未予调整就开始滴定;
d.观察记录滴定管内液面刻度时滴定前仰视,滴定后俯视;
e.酚酞指示剂由无色变为红色时立即停止滴定。
(5)NaOH溶液的物质的量浓度为______。