题目内容
下列事实能用勒沙特列原理解释的是( )
①由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
②实验室中用氯化钠固体与浓硫酸共热制取氯化氢气体
③用排饱和食盐水法收集Cl2
④温度控制在500℃有利于合成氨反应
⑤工业制
取金属钾Na(l)+ KCl(l) NaCl(l)+ K(g)选适宜的温度,使K成蒸气从反应混合物中分离出来
NaCl(l)+ K(g)选适宜的温度,使K成蒸气从反应混合物中分离出来
①由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
②实验室中用氯化钠固体与浓硫酸共热制取氯化氢气体
③用排饱和食盐水法收集Cl2
④温度控制在500℃有利于合成氨反应
⑤工业制
取金属钾Na(l)+ KCl(l)
 NaCl(l)+ K(g)选适宜的温度,使K成蒸气从反应混合物中分离出来
NaCl(l)+ K(g)选适宜的温度,使K成蒸气从反应混合物中分离出来 | A.②③⑤ | B.①③⑤ | C.①②③④⑤ | D.①②③⑤ |
A
试题分析:①由H2、I2蒸气、HI组成的平衡体系是反应前后气体体积相等的反应。加压后平衡不发生移动。由于增大压强,单位体积物质的量增大,所以颜色变深。不能用勒沙特列原理解释。错误。②实验室中用氯化钠固体与浓硫酸共热制取氯化氢气体的反应为吸热反应,升高温度,化学平衡向吸热反应方向移动,所以能产生更多的HCl气体。正确。③Cl2在水中存在平衡:Cl2+H2O
 H++Cl-+HClO。若水中含有NaCl,则NaCl电离产生的Cl-使生成物的浓度增大,根据平衡移动原理,增大生成物的浓度,平衡逆向移动,就可以减小Cl2的溶解及反应,故可用排饱和食盐水法收集Cl2。正确。④合成氨的反应为放热反应。升高温度,平衡逆向移动,对于合成氨不利。之所以温度控制在500℃是因为在此时催化剂的活性最大。错误。⑤工业制取金属钾Na(l)+ KCl(l)
H++Cl-+HClO。若水中含有NaCl,则NaCl电离产生的Cl-使生成物的浓度增大,根据平衡移动原理,增大生成物的浓度,平衡逆向移动,就可以减小Cl2的溶解及反应,故可用排饱和食盐水法收集Cl2。正确。④合成氨的反应为放热反应。升高温度,平衡逆向移动,对于合成氨不利。之所以温度控制在500℃是因为在此时催化剂的活性最大。错误。⑤工业制取金属钾Na(l)+ KCl(l)  NaCl(l)+ K(g)选适宜的温度,使K成蒸气从反应混合物中分离出来,由于减小了生成物的浓度,化学平衡正向移动,就可以得到更多的K。正确。故能用勒沙特列原理解释的是②③⑤。选项为A。
NaCl(l)+ K(g)选适宜的温度,使K成蒸气从反应混合物中分离出来,由于减小了生成物的浓度,化学平衡正向移动,就可以得到更多的K。正确。故能用勒沙特列原理解释的是②③⑤。选项为A。
练习册系列答案
相关题目
 CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H
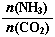 =3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为: 。
=3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为: 。 2NO(g)+O2(g)在体积固定的密闭容器中反应,达到平衡状态的标志是 ( )
2NO(g)+O2(g)在体积固定的密闭容器中反应,达到平衡状态的标志是 ( ) pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度为原来1.9倍,下列说法错误的是
pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度为原来1.9倍,下列说法错误的是 xC(g)+2D(g),经4min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.125mol·L-1·min-1,下列说法正确的是
xC(g)+2D(g),经4min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.125mol·L-1·min-1,下列说法正确的是 2NH3(g)(正反应为放热反应)。下列说法错误的是
2NH3(g)(正反应为放热反应)。下列说法错误的是 I(aq)的ΔH>0
I(aq)的ΔH>0
 2SO3至平衡。
2SO3至平衡。 pC(g)+qD(其中A和C都是无色气体),当达到平衡时,下列叙述正确的是( )
pC(g)+qD(其中A和C都是无色气体),当达到平衡时,下列叙述正确的是( )