��Ŀ����
��14�֣��о�CO2�����öԴٽ���̼���Ĺ���������Ҫ���塣
��1����CO2�뽹̿��������CO��CO�����������ȡ�
��֪����Fe2O3(s) + 3C(ʯī) =" 2Fe(s)" + 3CO(g) ��H 1 = +489��0 kJ��mol��1
��C(ʯī) +CO2(g) = 2CO(g) ��H 2 = +172��5 kJ��mol��1
��CO��ԭFe2O3(s)���Ȼ�ѧ����ʽΪ ��
��2��������̼�ϳɼ״���̼���ŵ��·���CO2ת��Ϊ�״����Ȼ�ѧ����ʽΪ��
CO2(g) +3H2(g) CH3OH(g) +H2O(g) ��H
CH3OH(g) +H2O(g) ��H
�ٸ÷�Ӧ��ƽ�ⳣ������ʽΪK= ��
��ȡһ�����CO2��H2�Ļ�����壨���ʵ���֮��Ϊ1��3������������ܱ������У�����������Ӧ��Ӧ�����в�ü״������������(CH3OH)�뷴Ӧ�¶�T�Ĺ�ϵ��ͼ1��ʾ����÷�Ӧ�Ħ�H 0 ���>������<����������

�������ֲ�ͬ�����·�����Ӧ�����CH3OH�����ʵ�����ʱ��仯��ͼ2��ʾ������I�����Ӧ��ƽ�ⳣ����С��ϵΪK�� K��(�>������<������)��
��3����CO2Ϊԭ�ϻ����Ժϳɶ������ʡ�
�ٹ�ҵ������[CO(NH2)2]��CO2��NH3��һ�������ºϳɣ��䷴Ӧ����ʽΪ ��
����̼��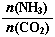 ��3����ƽ��ʱCO2��ת����Ϊ60%����NH3��ƽ��ת����Ϊ�� ��
��3����ƽ��ʱCO2��ת����Ϊ60%����NH3��ƽ��ת����Ϊ�� ��
����������Һ������ʽ��е�⣬CO2�ڵ缫�Ͽ�ת��Ϊ���飬�õ缫��Ӧ�ķ���ʽΪ ��
��1����CO2�뽹̿��������CO��CO�����������ȡ�
��֪����Fe2O3(s) + 3C(ʯī) =" 2Fe(s)" + 3CO(g) ��H 1 = +489��0 kJ��mol��1
��C(ʯī) +CO2(g) = 2CO(g) ��H 2 = +172��5 kJ��mol��1
��CO��ԭFe2O3(s)���Ȼ�ѧ����ʽΪ ��
��2��������̼�ϳɼ״���̼���ŵ��·���CO2ת��Ϊ�״����Ȼ�ѧ����ʽΪ��
CO2(g) +3H2(g)
 CH3OH(g) +H2O(g) ��H
CH3OH(g) +H2O(g) ��H�ٸ÷�Ӧ��ƽ�ⳣ������ʽΪK= ��
��ȡһ�����CO2��H2�Ļ�����壨���ʵ���֮��Ϊ1��3������������ܱ������У�����������Ӧ��Ӧ�����в�ü״������������(CH3OH)�뷴Ӧ�¶�T�Ĺ�ϵ��ͼ1��ʾ����÷�Ӧ�Ħ�H 0 ���>������<����������

�������ֲ�ͬ�����·�����Ӧ�����CH3OH�����ʵ�����ʱ��仯��ͼ2��ʾ������I�����Ӧ��ƽ�ⳣ����С��ϵΪK�� K��(�>������<������)��
��3����CO2Ϊԭ�ϻ����Ժϳɶ������ʡ�
�ٹ�ҵ������[CO(NH2)2]��CO2��NH3��һ�������ºϳɣ��䷴Ӧ����ʽΪ ��
����̼��
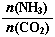 ��3����ƽ��ʱCO2��ת����Ϊ60%����NH3��ƽ��ת����Ϊ�� ��
��3����ƽ��ʱCO2��ת����Ϊ60%����NH3��ƽ��ת����Ϊ�� ������������Һ������ʽ��е�⣬CO2�ڵ缫�Ͽ�ת��Ϊ���飬�õ缫��Ӧ�ķ���ʽΪ ��
��1��Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) ��H = ��28��5 kJ��mol��1
��2����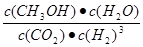 ���ڣ� �� ��>
���ڣ� �� ��>
��3����2��2NH3+CO2 CO(NH2)2+H2O 40 % ��CO2+8e��+8H+=CH4+2H2O
CO(NH2)2+H2O 40 % ��CO2+8e��+8H+=CH4+2H2O
��2����
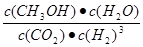 ���ڣ� �� ��>
���ڣ� �� ��>��3����2��2NH3+CO2
 CO(NH2)2+H2O 40 % ��CO2+8e��+8H+=CH4+2H2O
CO(NH2)2+H2O 40 % ��CO2+8e��+8H+=CH4+2H2O���������(1) �٣��ڡ�3�������ɵ�Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) ��H = ��28��5 kJ/mol����2���ٻ�ѧƽ�ⳣ���ǿ��淴Ӧ�ﵽƽ��״̬ʱ����������Ũ�ȵ���ָ���ij˻�����ַ�Ӧ��Ũ�ȵ���ָ���ij˻��ıȡ��Ը÷�Ӧ��˵��K=
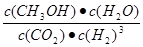 �����ɼ״������������(CH3OH)�뷴Ӧ�¶�T�Ĺ�ϵͼʾ��֪������Ӧ�ﵽƽ��������¶ȣ��״������������С��˵�������¶ȣ���ѧƽ�������ƶ�������ƫ���ƶ�ԭ���������¶��λ�����ƽ�������ȷ�Ӧ�����ƶ����淴Ӧ����Ϊ���ȷ�Ӧ����������ӦΪ���ȷ�Ӧ�����Ԧ�H<0�� �����ߢ��I�ȴﵽƽ�⡣˵���¶��¶����ߢ�>I�������¶ȸߣ�CH3OH�����ͣ�˵����ѧƽ�ⳣ��K��>K������3���ٸ��������غ㶨�ɣ���CO2��NH3��һ�������ºϳ�����[CO(NH2)2]�ķ�Ӧ����ʽΪ2NH3+CO2
�����ɼ״������������(CH3OH)�뷴Ӧ�¶�T�Ĺ�ϵͼʾ��֪������Ӧ�ﵽƽ��������¶ȣ��״������������С��˵�������¶ȣ���ѧƽ�������ƶ�������ƫ���ƶ�ԭ���������¶��λ�����ƽ�������ȷ�Ӧ�����ƶ����淴Ӧ����Ϊ���ȷ�Ӧ����������ӦΪ���ȷ�Ӧ�����Ԧ�H<0�� �����ߢ��I�ȴﵽƽ�⡣˵���¶��¶����ߢ�>I�������¶ȸߣ�CH3OH�����ͣ�˵����ѧƽ�ⳣ��K��>K������3���ٸ��������غ㶨�ɣ���CO2��NH3��һ�������ºϳ�����[CO(NH2)2]�ķ�Ӧ����ʽΪ2NH3+CO2 CO(NH2)2+H2O��
CO(NH2)2+H2O��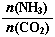 ��3������n(CO2)=amol,��n(NH3)=3amol�����ڴ�ƽ��ʱCO2��ת����Ϊ60%�����Է�Ӧ���ĵ�n(CO2)=0��6amol�������ݷ���ʽ�ж��ߵ����ʵ����Ĺ�ϵ��֪��Ӧ��NH3�����ʵ���n(NH3)=1��2amol����������ת����Ϊ(1��2amol����3amol)��100%=40%������������Һ������ʽ��е�⣬CO2�ڵ缫�Ͽ�ת��Ϊ���飬���������ɵã��õ缫��Ӧ�ķ���ʽΪCO2+8e��+8H+=CH4+2H2O��
��3������n(CO2)=amol,��n(NH3)=3amol�����ڴ�ƽ��ʱCO2��ת����Ϊ60%�����Է�Ӧ���ĵ�n(CO2)=0��6amol�������ݷ���ʽ�ж��ߵ����ʵ����Ĺ�ϵ��֪��Ӧ��NH3�����ʵ���n(NH3)=1��2amol����������ת����Ϊ(1��2amol����3amol)��100%=40%������������Һ������ʽ��е�⣬CO2�ڵ缫�Ͽ�ת��Ϊ���飬���������ɵã��õ缫��Ӧ�ķ���ʽΪCO2+8e��+8H+=CH4+2H2O��
��ϰ��ϵ�д�
�����Ŀ
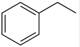 ��g����
��g����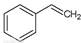 ��g��+H2��g������H=" +117.6" kJ/mol
��g��+H2��g������H=" +117.6" kJ/mol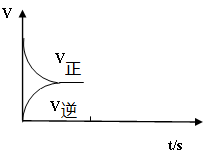
 һ��ʱ���ﵽ��ѧƽ��״̬���ı�ijһ����������˵����ȷ����
һ��ʱ���ﵽ��ѧƽ��״̬���ı�ijһ����������˵����ȷ����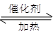 2SO3�����ж���ȷ����
2SO3�����ж���ȷ���� N2O3 + O2��N2O3�ֿɰ����зֽ⣺ N2O3
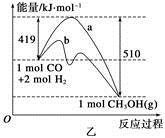
N2O3 + O2��N2O3�ֿɰ����зֽ⣺ N2O3 CH3OH(g)����ҵ��������CO����ȼ�ϼ״���
CH3OH(g)����ҵ��������CO����ȼ�ϼ״���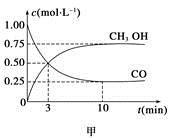 ��
�� 
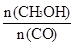 �������____________��
�������____________�� C(g)+D(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
C(g)+D(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£� Ni(CO)4(g)
Ni(CO)4(g) NaCl(l)+ K(g)ѡ���˵��¶�,ʹK�������ӷ�Ӧ������з������
NaCl(l)+ K(g)ѡ���˵��¶�,ʹK�������ӷ�Ӧ������з������