题目内容
使2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g) 2NH3(g)(正反应为放热反应)。下列说法错误的是
2NH3(g)(正反应为放热反应)。下列说法错误的是
 2NH3(g)(正反应为放热反应)。下列说法错误的是
2NH3(g)(正反应为放热反应)。下列说法错误的是| A.升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量变大 |
| B.升高平衡体系的温度(保持体积不变),混合气体的密度不变 |
| C.当反应达到平衡时,N2和H2的浓度比是1∶3 |
| D.当达到平衡时,充入氩气,并保持压强不变,平衡将逆向移动 |
A
升高温度,平衡向逆方向移动,由于气体的质量不变,物质的量增大,所以混合气体的平均相对分子质量减少,A错;由于混合气体的质量不变,密闭容器的体积不变,其密度不变,B正确;N2和H2起始浓度之比与消耗的物的量之比相同,达到平衡后浓度之比也相同,C正确;压强不变,加入稀有气体,混合气体的压强增大,要维持压强不变,相当于减少压强,平衡向气体体积增大的方向移动,即逆方向移动,D正确。答案选A。

练习册系列答案
相关题目
 CH3OH(g)。工业上依此用CO生产燃料甲醇。
CH3OH(g)。工业上依此用CO生产燃料甲醇。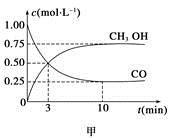
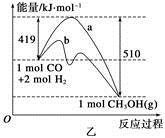
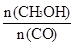 增大的有____________。
增大的有____________。 +2H2O。
+2H2O。 CH3OH(g)+H2O(g)能判断该反应已达化学反应限度标志的是 (填字母)。
CH3OH(g)+H2O(g)能判断该反应已达化学反应限度标志的是 (填字母)。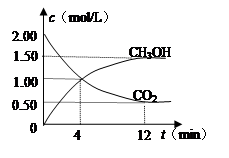
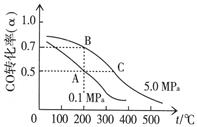
 CH3OH(g);已知密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率(α)与温度、压强的关系如右上图所示。
CH3OH(g);已知密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率(α)与温度、压强的关系如右上图所示。 2CO2(g)+ N2(g);△H<0。
2CO2(g)+ N2(g);△H<0。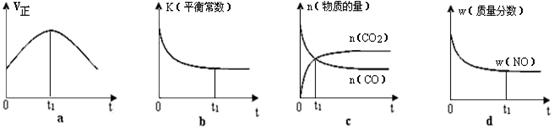
 Li1-xMnO4 + LixC
Li1-xMnO4 + LixC LiMnO4 + C
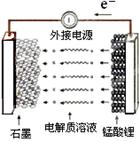
LiMnO4 + C NaCl(l)+ K(g)选适宜的温度,使K成蒸气从反应混合物中分离出来
NaCl(l)+ K(g)选适宜的温度,使K成蒸气从反应混合物中分离出来  2SO3(g)+Q (Q>0),将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
2SO3(g)+Q (Q>0),将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题: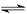 2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
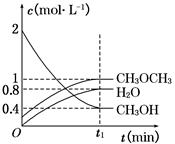
 CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1。在T1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1。在T1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。