题目内容
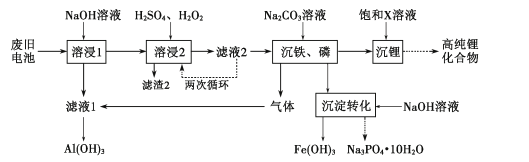
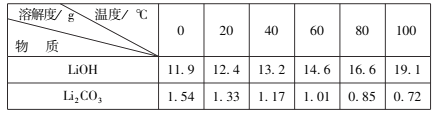
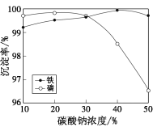
【题目】工业上常用水合肼(N2H4H2O)还原法制取碘化钠,工艺流程如图:
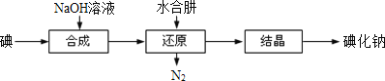
已知:I2与NaOH溶液反应,其氧化产物与还原产物的物质的量之比为1:5
(1)写出水合肼还原过程的化学反应方程式_____。
(2)若加入的水合肼已过量,请设计实验方案检验_____。
【答案】3N2H4H2O+2NaIO3=3N2↑+2NaI+9H2O 取少量反应后溶液,加入少量淀粉溶液,再加入稀硫酸至溶液呈酸性,若没有出现蓝色,则加入的水合肼已过量
【解析】
I2与NaOH溶液反应,其氧化产物与还原产物的物质的量之比为1:5,则反应方程式为:3I2 + 3NaOH =5 NaI + NaIO3 +3H2O, NaIO3被水合肼还原为NaI,水合肼变为N2,再结晶得到NaI。
⑴ NaIO3被水合肼还原为NaI,水合肼变为N2,因此水合肼还原过程的化学反应方程式3N2H4H2O+2NaIO3=3N2↑+2NaI+9H2O;故答案为:3N2H4H2O+2NaIO3=3N2↑+2NaI+9H2O。
⑵利用NaIO3、NaI在酸性条件下反应生成I2,I2遇见淀粉变蓝的特性,因此设计实验方案为取少量反应后溶液,加入少量淀粉溶液,再加入稀硫酸至溶液呈酸性,若没有出现蓝色,则加入的水合肼已过量;故答案为:取少量反应后溶液,加入少量淀粉溶液,再加入稀硫酸至溶液呈酸性,若没有出现蓝色,则加入的水合肼已过量。

练习册系列答案
相关题目