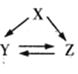题目内容
【题目】以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如图,下列说法不正确的是( )

A.在阴极室,发生的电极反应为:2H2O+2e-=2OH-+H2↑
B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO42-+2H+![]() Cr2O72-+H2O向右移动
Cr2O72-+H2O向右移动
C.该制备过程总反应的化学方程式为:4K2CrO4+4H2O![]() 2K2Cr2O7+4KOH+2H2↑+O2↑
2K2Cr2O7+4KOH+2H2↑+O2↑
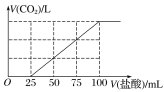
D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比为d,则此时铬酸钾的转化率为1-0.5d
【答案】D
【解析】
A. 在阴极室,发生的电极反应为:2H2O+2e- = 2OH-+H2↑,故A正确;
B. 在阳极室,OH-放电,阳极区H+浓度增大,使平衡2CrO42+2H+![]() Cr2O72+H2O向右移动,溶液逐渐由黄色变为橙色,故B正确;
Cr2O72+H2O向右移动,溶液逐渐由黄色变为橙色,故B正确;
C. 该制备过程总反应的化学方程式为:4K2CrO4+4H2O![]() 2K2Cr2O7+4KOH+2H2↑+O2↑,故C正确;
2K2Cr2O7+4KOH+2H2↑+O2↑,故C正确;
D. 设加入反应容器内的K2CrO4为1mol,反应过程中有xmolK2CrO4转化为K2Cr2O7,则阳极区剩余K2CrO4为(1x)mol,对应的n(K)=2(1x)mol,n(Cr)=(1x)mol,生成的K2Cr2O7为![]() mol,对应的n(K)=xmol,n(Cr)=xmol,根据:K与Cr的物质的量之比为d,
mol,对应的n(K)=xmol,n(Cr)=xmol,根据:K与Cr的物质的量之比为d,![]() ,解得x=2d,转化率为
,解得x=2d,转化率为![]() ,故D错误。
,故D错误。
综上所述,答案为D。

练习册系列答案
相关题目
【题目】下表各组物质(或者它们的溶液)通过一步反应可实现如图所示的转化的是
选项 | X | Y | Z |
|
A | Si | Na2SiO3 | H2SiO3 | |
B | S | H2S | SO2 | |
C | Al2O3 | NaAlO2 | Al2(SO4)3 | |
D | Mg(OH)2 | MgCO3 | MgCl2 |
A.AB.BC.CD.D