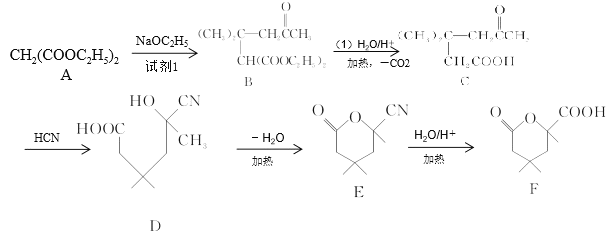
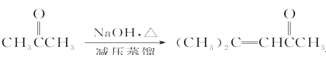题目内容
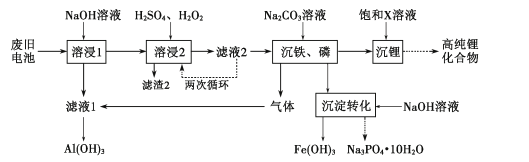
【题目】废弃锂离子电池的资源化处理日益重要。从废旧磷酸铁锂电池的正极材料(含LiFePO4、石墨粉和铝箔等)中综合回收锂、铁和磷等的工艺流程如图所示:
有关数据:25℃时,Ksp(FePO4)=1.3×10-22、Ksp[Fe(OH)3]=2.6×10-39。
回答下列问题:
(1)“溶浸1”中铝溶解的化学方程式为___。
(2)完成“溶浸2”反应的离子方程式___:
![]() LiFePO4+
LiFePO4+![]() H2O2+
H2O2+![]() =
=![]() Li++
Li++![]() +
+![]() H2PO4-+
H2PO4-+![]() H2O
H2O
(3)“滤渣2”的主要成分是___。
(4)“滤液2”循环两次的目的是___。
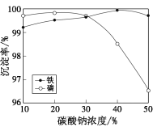
(5)“沉铁、磷”时,析出FePO4沉淀,反应的离子方程式为__。实验中,铁、磷的沉淀率结果如图所示。碳酸钠浓度大于30%后,铁沉淀率仍然升高,磷沉淀率明显降低,其可能原因是___。
(6)“沉淀转化”反应:FePO4+3OH-Fe(OH)3+PO43-。用此反应的化学平衡常数说明转化能否完全___?
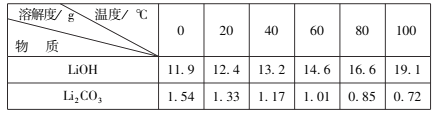
(7)为了充分沉淀,“沉锂”时所用的X和适宜温度是___(填标号)。
A.NaOH20-40℃ B.NaOH80-100℃
C.Na2CO320-40℃ D.Na2CO360-80℃
【答案】2Al+2H2O+2NaOH=2NaAlO2+3H2↑ 2LiFePO4+H2O2+6H+=2Li++2Fe3++2H2PO4-+2H2O 石墨 提高浸出液的浓度(或提高双氧水和硫酸的利用率等其他合理答案) Fe3++2H2PO4-+CO32-= FePO4↓+ CO2↑+ H2O Na2CO3水解产生的c(OH-)增大,与Fe3+结合生成Fe (OH)3沉淀,而使留在溶液中的PO43-增大 K=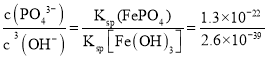 =5.0×1016,K很大,说明反应完全进行 D
=5.0×1016,K很大,说明反应完全进行 D
【解析】
废旧磷酸铁锂电池的正极材料(含LiFePO4、石墨粉和铝箔等)加入氢氧化钠进行减溶,铝箔与氢氧化钠反应生成偏铝酸钠,过滤后得到滤液1,滤液1为偏铝酸钠溶液,过滤后的滤渣再加入过量浓硫酸进行酸溶,同时加入双氧水,将亚铁离子氧化为三价铁,并进行多次循环,确保亚铁离子全部转化,在进行过滤得到滤渣2和滤液2,滤渣2为石墨粉,滤液2主要含有Fe3+、Li+、H2PO4-和SO42-溶液,向滤液2加入碳酸钠,Fe3+、H2PO4-与碳酸钠反应,转化为磷酸铁沉淀和二氧化碳,生成的二氧化碳气体通入滤液1中反应生成氢氧化铝,磷酸铁中加入氢氧化钠溶液转化为氢氧化铁和磷酸钠晶体,向沉铁、磷后的溶液加入碳酸钠得到碳酸锂沉淀,再对碳酸锂进行一系列处理最后得到高纯锂化合物,据此分析解答。
(1)根据分析,“溶浸1”中铝溶解的化学方程式为2Al+2H2O+2NaOH=2NaAlO2+3H2↑;
(2)完成“溶浸2”为LiFePO4与过量浓硫酸进行酸溶,同时加入双氧水,将亚铁离子氧化为三价铁,离子方程式:2LiFePO4+H2O2+6H+=2Li++2Fe3++2H2PO4-+2H2O;
(3)根据分析,“滤渣2”的主要成分是石墨;
(4)“滤液2”循环两次的目的是提高浸出液的浓度(或提高双氧水和硫酸的利用率等其他合理答案)
(5)“沉铁、磷”时,析出FePO4沉淀,反应的离子方程式为Fe3++2H2PO4-+CO32-= FePO4↓+ CO2↑+ H2O;实验中,铁、磷的沉淀率结果如图所示。碳酸钠浓度大于30%后,铁沉淀率仍然升高,磷沉淀率明显降低,其可能原因是Na2CO3水解产生的c(OH-)增大,与Fe3+结合生成Fe (OH)3沉淀,而使留在溶液中的PO43-增大;
(6)“沉淀转化”反应:FePO4+3OH-Fe(OH)3+PO43-。K=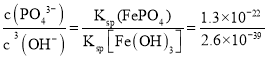 =5.0×1016,K很大,说明反应完全进行。
=5.0×1016,K很大,说明反应完全进行。
(7)结合表格数据,碳酸锂的溶解度远小于氢氧化锂,为了充分沉淀,“沉锂”时所用的X应为碳酸钠,60-80℃左右溶解度较小,答案选D。