题目内容
在含有硝酸铜、硝酸铁、硝酸银各0.1 mol的混合溶液中加入铁粉,充分反应后,析出3.2 g铜,则向溶液中加入的铁粉质量为 ( )
| A.5.6 g | B.2.8 g | C.8.4g | D.14 g |
C
由阳离子的氧化顺序可知,铁依次发生如下反应:
Fe+2Ag+=Fe2++2Ag 2Fe3++Fe=3Fe2+ Fe+Cu2+=Cu+Fe2+
由于最终析出3.2 g铜,也就是说前两个反应已经进行完全,而铜只有一半参加了反应,所以共消耗铁粉为:0.05+0.05+0.05=0.15mol,即共8.4g
答案为C
Fe+2Ag+=Fe2++2Ag 2Fe3++Fe=3Fe2+ Fe+Cu2+=Cu+Fe2+
由于最终析出3.2 g铜,也就是说前两个反应已经进行完全,而铜只有一半参加了反应,所以共消耗铁粉为:0.05+0.05+0.05=0.15mol,即共8.4g
答案为C

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
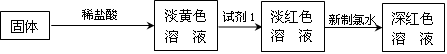
 ;
; 并指明该氧化还原反应的还原剂是 ,氧化剂是 。
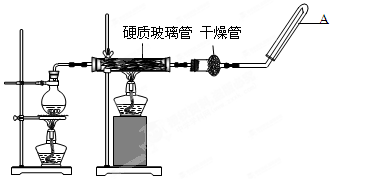
并指明该氧化还原反应的还原剂是 ,氧化剂是 。 mL 2 mol·L-1盐酸充分反应后,溶
mL 2 mol·L-1盐酸充分反应后,溶 液中FeCl2的物质的量为
液中FeCl2的物质的量为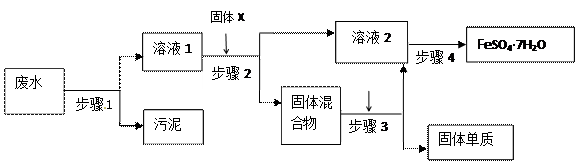 (1)步骤
(1)步骤 1的主要操作是 ,需用到的玻璃仪器有 , _______、 。
1的主要操作是 ,需用到的玻璃仪器有 , _______、 。