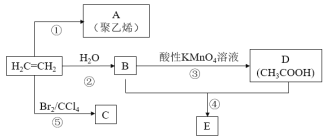
题目内容
【题目】物质的类别和核心元素的化合价是研究物质性质的两个基本视角。根据下图,完成下列填空:
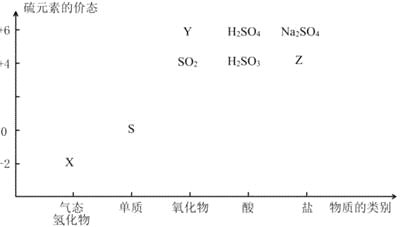
(1)上图中X的电子式为_________;其水溶液长期在空气中放置容易变浑浊,用化学方程式表示该变化__________;该变化体现出硫元素的非金属性比氧元素______(填“强”或“弱”)。用原子结构解释原因____________。
(2)Na2S2O3是一种用途广泛的钠盐。下列物质用于Na2S2O3的制备,从氧化还原反应的角度,理论上有可能的是______(填字母序号)。
a.Na2S+ S b.Z+ S c.Na2SO3 + Y d.NaHS + NaHSO3
(3)SO2是主要大气污染物之一。工业上烟气脱硫的方法之一是用碱液吸收,其流程如图: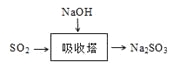 。
。
该法吸收快,效率高。若在操作中持续通入含SO2的烟气,则最终产物为________。室温下,0.1mol/L①亚硫酸钠 ②亚硫酸氢钠 ③硫化钠 ④硫氢化钠的四种溶液的pH由大到小的顺序是________(用编号表示)。
已知:H2S:Ki1=1.3×10-7 Ki2=7.1×10-15 H2SO3:Ki1=1.3×10-2 Ki2=6.2×10-8
(4)治理含CO、SO2的烟道气,也可以将其在催化剂作用下转化为单质S和无毒的气体:2CO(g) + SO2(g)![]() S(s) + 2CO2(g)。一定条件下,将CO与SO2以体积比为4∶1置于恒容密闭容器中发生上述反应,下列选项能说明反应达到平衡状态的是______(填写字母序号)。
S(s) + 2CO2(g)。一定条件下,将CO与SO2以体积比为4∶1置于恒容密闭容器中发生上述反应,下列选项能说明反应达到平衡状态的是______(填写字母序号)。
a.υ (CO) ∶υ(SO2) = 2∶1 b.平衡常数不变
c.气体密度不变 d.CO2和SO2的体积比保持不变
测得上述反应达平衡时,混合气体中CO的体积分数为![]() ,则SO2的转化率为________。
,则SO2的转化率为________。
【答案】![]() 2H2S + O2 =2S↓+2H2O 弱 氧和硫同主族,同主族元素最外层电子数相同,从上到下,电子层数增多,原子半径增大,得电子能力逐渐减弱 bd NaHSO3 ③>①>④>② cd 60%
2H2S + O2 =2S↓+2H2O 弱 氧和硫同主族,同主族元素最外层电子数相同,从上到下,电子层数增多,原子半径增大,得电子能力逐渐减弱 bd NaHSO3 ③>①>④>② cd 60%
【解析】
(1)根据图示X为S的气态氢化物,X是H2S,H2S的电子式为![]() ;H2S的水溶液长期在空气中放置容易被空气中的氧气氧化生成硫,反应的化学方程式为O2+2H2S=2S↓+2H2O,该变化体现出硫元素的非金属性比氧元素弱,原因是:氧和硫同主族,从上到下,电子层数增多,原子半径增大,得电子能力逐渐减弱。
;H2S的水溶液长期在空气中放置容易被空气中的氧气氧化生成硫,反应的化学方程式为O2+2H2S=2S↓+2H2O,该变化体现出硫元素的非金属性比氧元素弱,原因是:氧和硫同主族,从上到下,电子层数增多,原子半径增大,得电子能力逐渐减弱。
(2)Na2S2O3中S显+2价;a.Na2S、S中S元素的化合价依次为-2价、0价,均低于+2价,不可能;b.根据图示Z为Na2SO3,Na2SO3、S中S元素的化合价依次为+4价、0价,满足高价跟低价生成中间价态,可能;c.根据图示Y为SO3,Na2SO3、SO3中S元素的化合价依次为+4价、+6价,均高于+2价,不可能;d.NaHS 、NaHSO3中S元素的化合价依次为-2价、+4价,满足高价跟低价生成中间价态,可能;答案选bd。
(3)若在操作中持续通入含SO2的烟气,最终SO2与Na2SO3反应生成NaHSO3,即最终产物为NaHSO3;根据电离平衡常数可知,酸性:H2SO3>H2S>HSO3->HS-,结合越弱越水解,硫化钠的水解程度最大,pH最大,亚硫酸氢钠水解程度最小,pH最小,故四种溶液的pH由大到小的顺序是③>①>④>②。
(4)a.υ (CO) ∶υ(SO2) = 2∶1没有指明反应速率的方向,不能说明反应达到平衡;b.平衡常数只与温度有关,平衡常数不变不能说明反应达到平衡;c.气体密度与气体的质量有关,因为S是固体,该反应属于气体质量变化的反应,气体密度不变,表示气体质量不变,说明是平衡状态;d.CO2和SO2的体积比保持不变,表示正反应速率等于逆反应速率,说明是平衡状态;答案选cd。
设起始加入SO2物质的量为x,转化SO2物质的量为y
2CO(g) + SO2(g)![]() S(s) + 2CO2(g)
S(s) + 2CO2(g)
起始(mol) 4x x 0
转化(mol) 2y y 2y
平衡(mol) 4x-2y x-y 2y
平衡时CO的体积分数=![]() ,解得y=
,解得y=![]() ,SO2的转化率为
,SO2的转化率为![]() =60%。
=60%。

【题目】1乙氧基萘常用作香料,也可合成其他香料。实验室制备1乙氧基萘的过程如下:
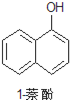 +CH3CH2OH
+CH3CH2OH![]()
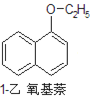 +H2O
+H2O
已知:1萘酚的性质与苯酚相似,有难闻的苯酚气味。相关物质的物理常数:
物质 | 相对分子质量 | 状态 | 熔点(℃) | 沸点(℃) | 溶解度 | |
水 | 乙醇 | |||||
1萘酚 | 144 | 无色或黄色菱形结晶或粉末 | 96℃ | 278℃ | 微溶于水 | 易溶于乙醇 |
1乙氧基萘 | 172 | 无色液体 | 5.5℃ | 267℃ | 不溶于水 | 易溶于乙醇 |
乙醇 | 46 | 无色液体 | 114.1℃ | 78.5℃ | 任意比混溶 | |
(1)将一定量1萘酚溶于无水乙醇中,并加入少量浓硫酸混合。将混合液置于如图所示的容器中加热充分反应。实验中使用过量乙醇的原因是__________。
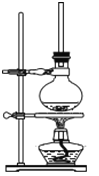
(2)装置中长玻璃管的作用是:______。
(3)该反应不能用实验室制备乙酸乙酯的装置,简述理由____________;
(4)反应结束,需要提纯产物,在下面的横线上填上相应操作的名称:倒入冷水,碱洗并_______ → 水洗并_______ →加入CaCl2干燥并______→___________。