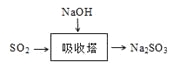
题目内容
【题目】常温下,下列溶液均为0.1mol·L-1,有关叙述正确的是( )
A.碳酸氢钠溶液中c(H2CO3)>c(CO32-)
B.碳酸钠溶液比碳酸氢钠溶液的pH小
C.碳酸钠溶液中c(OH-)=c(H+)+c(H2CO3)+c(CO32-)
D.碳酸钠溶液中滴加盐酸至pH=7,所得溶液的溶质只有NaCl
【答案】A
【解析】
A. 碳酸氢钠溶液呈弱碱性,碳酸氢根水解程度大于电离程度,因此水解产生的碳酸浓度比电离产生的碳酸根浓度大,A正确;
B.碳酸钠水解程度比碳酸氢钠水解程度大,碳酸钠溶液比碳酸氢钠溶液的pH大,B错误;
C. 碳酸钠溶液中存在物料守恒:![]() ,也存在电荷守恒:
,也存在电荷守恒:![]() ,合并得出质子守恒:
,合并得出质子守恒: ![]() ,C错误;
,C错误;
D. 碳酸钠溶液中滴加盐酸至pH=7,所得溶液的溶质除了氯化钠外,还有碳酸氢钠和碳酸,D错误;
答案选A。

 孟建平名校考卷系列答案
孟建平名校考卷系列答案【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)如图是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图:
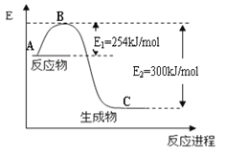
请写出NO2和CO反应的热化学方程式:___。
(2)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g)+Q(Q>0),其化学平衡常数K与T的关系如下表:
2NH3(g)+Q(Q>0),其化学平衡常数K与T的关系如下表:
T/K | 298 | 398 | 498 | … |
K/ | 4.1×106 | K1 | K2 | … |
请完成下列问题:比较K1、K2的大小:K1___K2(填写“>”、“=”或“<”)
(3)判断该反应达到化学平衡状态的依据的是___(选填字母序号)。
A.2v(H2)正=3v(NH3)逆 B.2v(N2)正=v(H2)逆
C.容器内压强保持不变 D.混合气体的密度保持不变
(4)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。盐酸肼第一步水解反应的离子方程式___;
盐酸肼水溶液中离子浓度的排列顺序正确的是___(填序号)。
a.c(Cl-)>c(N2H62+)>c(H+)>c(OH-)
b.c(Cl-)>c([N2H5H2O]+)>c(H+)>c(OH-)
c.2c(N2H62+)+c([N2H5H2O]+)+c(H+)=c(Cl-)+c(OH-)
d.2c(N2H62+)+2c([N2H5H2O]+)+2c([N2H42H2O]=c(Cl-)