题目内容
以下涉及的物质中A、B、C都是化合物;请注意各小题之间可能有的联系.
(1)一定条件下,9.80g NH4Br跟3.60g的某钙盐A恰好反应,生成了4.48L(标准状况)气态产物B和固体产物C.标准状况下,B气体的密度为0.76g/L,氮的质量分数为82.35%,其余是氢.试求B的分子式 .
(2)25℃、101.3KPa时,气体摩尔体积为24.5L/mol.该状况下,1体积水(密度为1g/cm3)吸收560体积B气体得到密度为0.91g/cm3的溶液,则该溶液中溶质的质量分数为 %(溶液中的溶质以B计量;保留2位小数);溶液的物质的量浓度为 mol/L(保留2位小数).
(3)在催化剂作用下,B可和NO、NO2混合气体反应生成液态水和一种单质气体D(可不考虑气体反应物与生成的液态水之间的作用).
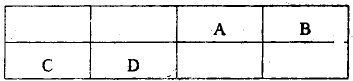
在常温常压下,将密度一定的NO、NO2混合气体和B在不同体积比时进行了四次实验,所得数据如下:
则原NO、NO2混合气体中NO的体积分数为 %;第四次实验所得气体的平均摩尔质量为 (保留2位小数).
(4)将9.80g NH4Br跟过量的氧化鈣共热,充分反应后生成水、1.70g B气体和固体产物C,则C的化学式为 ;试根据有关数据,求钙盐A的化学式 .
(1)一定条件下,9.80g NH4Br跟3.60g的某钙盐A恰好反应,生成了4.48L(标准状况)气态产物B和固体产物C.标准状况下,B气体的密度为0.76g/L,氮的质量分数为82.35%,其余是氢.试求B的分子式
(2)25℃、101.3KPa时,气体摩尔体积为24.5L/mol.该状况下,1体积水(密度为1g/cm3)吸收560体积B气体得到密度为0.91g/cm3的溶液,则该溶液中溶质的质量分数为
(3)在催化剂作用下,B可和NO、NO2混合气体反应生成液态水和一种单质气体D(可不考虑气体反应物与生成的液态水之间的作用).
在常温常压下,将密度一定的NO、NO2混合气体和B在不同体积比时进行了四次实验,所得数据如下:
| 实验次数 | B与混合气体的体积比 | 反应后气体密度(已换算为标准状况;g/L) |
| 第一次 | 1.0 | 1.35 |
| 第二次 | 1.2 | 1.25 |
| 第三次 | 2.0 | 1.04 |
| 第四次 | 2.2 | -- |
(4)将9.80g NH4Br跟过量的氧化鈣共热,充分反应后生成水、1.70g B气体和固体产物C,则C的化学式为
考点:化学方程式的有关计算,溶液中溶质的质量分数及相关计算,有关混合物反应的计算,几组未知物的检验
专题:计算题
分析:(1)标况下B气体的密度为0.76g/L,则B的相对分子质量=0.76×22.4=17,其中氮的质量分数为82.35%,则B分子中N原子数目=
=1、其余是氢,则H原子数目=
=3,则B为NH3;
(2)假设氨气体积为560L,则水为1L,根据n=
计算氨气的物质的量,再根据m=nM计算氨气的质量,进而计算溶液质量分数;
根据c=
计算溶液物质的量浓度;
(3)在催化剂作用下,NH3可和NO、NO2混合气体反应生成液态水和一种单质气体D,则D为N2,
第一次反应气体的相对分子质量=1.35×22.4=30.24,
第二次反应气体的相对分子质量=1.25×22.4=28,
第三次反应气体的相对分子质量=1.04×22.4=23.2,
由反应后气体相对分子质量可知,第二次实验恰好完全反应,气体为N2,说明第一次剩余氨气不足,第三次剩余氨气有剩余,
令第二次实验中NO、NO2的总物质的量为1mol,则NH3为1.2 mol,设NO为x mol,则NO2为(1-x)mol,根据电子转移守恒列方程计算,进而计算NO的体积分数;
令第四次实验中NO、NO2的总物质的量为1mol,则NH3为2.2 mol,NO为0.2 mol,则NO2为(1-0.2)mol=0.8mol,令参加反应的氨气为y mol,根据电子转移守恒列方程计算,进而计算剩余氨气,根据N原子守恒计算生成N2的物质的量,再根据
=
计算;
(4)将9.80g NH4Br跟过量的氧化钙共热,充分反应后生成水、1.70g NH3气体和固体产物C,由元素守恒,则C的化学式为CaBr2;
由(1)9.80g NH4Br跟3.60g的某钙盐A恰好反应,生成了4.48L(标准状况)NH3和CaBr2,根据原子守恒计算3.6gA含有各元素原子物质的量,进而确定A的化学式.
| 17×82.5% |
| 14 |
| 17-14 |
| 1 |
(2)假设氨气体积为560L,则水为1L,根据n=
| V |
| Vm |
根据c=
| 1000ρw |
| M |
(3)在催化剂作用下,NH3可和NO、NO2混合气体反应生成液态水和一种单质气体D,则D为N2,
第一次反应气体的相对分子质量=1.35×22.4=30.24,
第二次反应气体的相对分子质量=1.25×22.4=28,
第三次反应气体的相对分子质量=1.04×22.4=23.2,
由反应后气体相对分子质量可知,第二次实验恰好完全反应,气体为N2,说明第一次剩余氨气不足,第三次剩余氨气有剩余,
令第二次实验中NO、NO2的总物质的量为1mol,则NH3为1.2 mol,设NO为x mol,则NO2为(1-x)mol,根据电子转移守恒列方程计算,进而计算NO的体积分数;
令第四次实验中NO、NO2的总物质的量为1mol,则NH3为2.2 mol,NO为0.2 mol,则NO2为(1-0.2)mol=0.8mol,令参加反应的氨气为y mol,根据电子转移守恒列方程计算,进而计算剩余氨气,根据N原子守恒计算生成N2的物质的量,再根据
. |
| M |
| m总 |
| n总 |
(4)将9.80g NH4Br跟过量的氧化钙共热,充分反应后生成水、1.70g NH3气体和固体产物C,由元素守恒,则C的化学式为CaBr2;
由(1)9.80g NH4Br跟3.60g的某钙盐A恰好反应,生成了4.48L(标准状况)NH3和CaBr2,根据原子守恒计算3.6gA含有各元素原子物质的量,进而确定A的化学式.
解答:
解:(1)标况下B气体的密度为0.76g/L,则B的相对分子质量=0.76×22.4=17,其中氮的质量分数为82.35%,则B分子中N原子数目=
=1、其余是氢,则H原子数目=
=3,则B为NH3,
故答案为:NH3;
(2)假设氨气体积为560L,则水为1L,25℃、101.3KPa时,气体摩尔体积为24.5L/mol,氨气的物质的量=
=22.86mol,氨气的质量=22.86mol×17g/mol=388.62g,1L水的质量为1000g,则所得溶液质量分数=
×100%=27.99%;
所得溶液密度为0.91g/cm3,故溶液物质的量浓度=
mol/L=14.98mol/L,
故答案为:27.99;14.98;
(3)在催化剂作用下,NH3可和NO、NO2混合气体反应生成液态水和一种单质气体D,则D为N2,
第一次反应气体的相对分子质量=1.35×22.4=30.24,
第二次反应气体的相对分子质量=1.25×22.4=28,
第三次反应气体的相对分子质量=1.04×22.4=23.2,
由反应后气体相对分子质量可知,第二次实验恰好完全反应,气体为N2,说明第一次剩余氨气不足,第三次剩余氨气有剩余,
令第二次实验中NO、NO2的总物质的量为1mol,则NH3为1.2 mol,设NO为x mol,则NO2为(1-x)mol,根据电子转移守恒:2x+4(1-x)=1.2×[0-(-3)],解得x=0.2,故NO的体积分数为
×100%=20%;
令第四次实验中NO、NO2的总物质的量为1mol,则NH3为2.2 mol,NO为0.2 mol,则NO2为(1-0.2)mol=0.8mol,令参加反应的氨气为y mol,根据电子转移守恒:2×0.2+4×0.8=y×[0-(-3)],解得y=1.2,剩余氨气为:2.2mol-1.2mol=1mol,根据N原子守恒可知生成N2的物质的量=
=1.1mol,故反应后气体的平均摩尔质量=
=22.76g/mol,
故答案为:20;22.76g/mol;
(4)将9.80g NH4Br跟过量的氧化钙共热,充分反应后生成水、1.70g NH3气体和固体产物C,由元素守恒,则C的化学式为CaBr2,
由(1)9.80g NH4Br跟3.60g的某钙盐A恰好反应,生成了4.48L(标准状况)NH3和CaBr2,
NH4Br的物质的量=
=0.1mol,由Br元素守恒可知CaBr2为0.05mol,由Ca元素守恒可知,3.6gA中含有Ca原子为0.05mol,氨气的物质的量=
=0.2mol,由N元素守恒可知,3.6gA中含有N原子为0.2mol-0.1mol=0.1mol,由H元素守恒,3.6gA中含有H原子为0.2mol×3-0.1mol×4=0.2mol,
故3.6gA中Ca、N、H原子物质的量之比=0.05:0.1:0.2=1:2:4,故A的化学式为CaN2H4,
故答案为:CaN2H4.
| 17×82.5% |
| 14 |
| 17-14 |
| 1 |
故答案为:NH3;
(2)假设氨气体积为560L,则水为1L,25℃、101.3KPa时,气体摩尔体积为24.5L/mol,氨气的物质的量=
| 560L |
| 24.5L/mol |
| 388.62g |
| 1000g+388.62g |
所得溶液密度为0.91g/cm3,故溶液物质的量浓度=
| 1000×0.91×27.99% |
| 17 |
故答案为:27.99;14.98;
(3)在催化剂作用下,NH3可和NO、NO2混合气体反应生成液态水和一种单质气体D,则D为N2,
第一次反应气体的相对分子质量=1.35×22.4=30.24,
第二次反应气体的相对分子质量=1.25×22.4=28,
第三次反应气体的相对分子质量=1.04×22.4=23.2,
由反应后气体相对分子质量可知,第二次实验恰好完全反应,气体为N2,说明第一次剩余氨气不足,第三次剩余氨气有剩余,
令第二次实验中NO、NO2的总物质的量为1mol,则NH3为1.2 mol,设NO为x mol,则NO2为(1-x)mol,根据电子转移守恒:2x+4(1-x)=1.2×[0-(-3)],解得x=0.2,故NO的体积分数为
| 0.2mol |
| 1mol |
令第四次实验中NO、NO2的总物质的量为1mol,则NH3为2.2 mol,NO为0.2 mol,则NO2为(1-0.2)mol=0.8mol,令参加反应的氨气为y mol,根据电子转移守恒:2×0.2+4×0.8=y×[0-(-3)],解得y=1.2,剩余氨气为:2.2mol-1.2mol=1mol,根据N原子守恒可知生成N2的物质的量=
| 1mol+1.2mol |
| 2 |
| 1mol×17g/mol+1.1mol×28g/mol |
| 1mol+1.1mol |
故答案为:20;22.76g/mol;
(4)将9.80g NH4Br跟过量的氧化钙共热,充分反应后生成水、1.70g NH3气体和固体产物C,由元素守恒,则C的化学式为CaBr2,
由(1)9.80g NH4Br跟3.60g的某钙盐A恰好反应,生成了4.48L(标准状况)NH3和CaBr2,
NH4Br的物质的量=
| 9.8g |
| 98g/mol |
| 4.48L |
| 22.4L/mol |
故3.6gA中Ca、N、H原子物质的量之比=0.05:0.1:0.2=1:2:4,故A的化学式为CaN2H4,
故答案为:CaN2H4.
点评:本题考查无机物推断、混合物计算、溶液浓度有关计算,题目综合性较大,计算量大,为易错题目,侧重考查学生分析解决问题的能力,难度较大.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
X、Y、Z、R、W是5种短周期元素,原子序数依次增大;它们可组成离子化合物Z2Y和共价化合物RY3、XW4;已知Y、R同主族,Z、R、W同周期.下列说法错误的是( )
| A、气态氢化物稳定性:HmW>HnR |
| B、标准状况下,1mol XW4的体积约为22.4L |
| C、Y和Z形成的某种化合物中含离子键、非极性健 |
| D、Y、Z、R三者形成的某种化合物溶于水后,可形成碱性溶液 |
下列常见有机物中,既能发生取代反应,又能使溴的CCl4溶液反应褪色的是( )
| A、甲苯 |
B、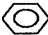 |
| C、植物油 |
| D、CH3COOH |
V L含有(NH4)2SO4、NH4NO3的混合溶液,加入a mol NaOH后加热,恰好使NH3全部逸出;又加入b mol BaCl2,刚好使SO42-完全沉淀.则原混合溶液中NH4NO3的物质的量浓度为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
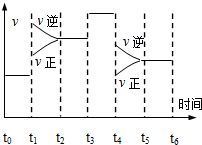 2013年冬季,雾霾天气多次肆虐我国东部地区.其中汽车尾气是造成空气污染的原因之一,研究控制汽车尾气成为保护环境的首要任务.
2013年冬季,雾霾天气多次肆虐我国东部地区.其中汽车尾气是造成空气污染的原因之一,研究控制汽车尾气成为保护环境的首要任务.