题目内容
【题目】已知在稀溶液中,强酸跟强碱发生中和反应生成1mol水时的反应热叫做中和热。现利用如图装置进行中和热的测定,请回答下列问题:
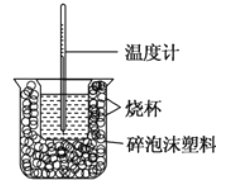
(1)图中缺少的仪器或用品有______、______。
(2)做一次完整的中和热测定实验,温度计需使用_____次。
(3)把温度为15.0℃,浓度为0.5mol/L的酸溶液和0.55mol/L的碱溶液各50mL混合(溶液密度均为1g/mL),生成溶液的比热容c=4.18 J·g-1·℃-1,轻轻搅动,测得酸碱混合液的温度变化数据如下:
反应物 | 起始温度t1/℃ | 终止温度t2/℃ | 中和热 |
HCl+NaOH | 15.0 | 18.3 | △H1 |
HCl+NH3·H2O | 15.0 | 18.0 | △H2 |
①计算表格中第一组实验测出的中和热△H1=______(保留一位小数)。
②写出表格中第二组实验的热化学方程式:_______________(保留一位小数)。
③两组实验结果差异的原因是________________。
④碱溶液过量的原因是___________。
【答案】 环形玻璃搅拌棒 烧杯上方的泡沫塑料板或硬纸板 3 -55.2KJ/mol HC1(aq)+NH3·H2O(aq)===NH4Cl(aq)+H2O(1)△H=-50.2kJ/mol NH3·H2O是弱碱,在中和过程中NH3·H2O发生电离,要吸热,因而放热少 使酸完全反应
【解析】(1)根据中和热的测定装置及该图所示可判断,图中有两处未画出,它们分别是环形玻璃搅拌棒、烧杯上方的泡沫塑料盖;(2)做一次完整的中和热测定实验,温度计需测量反应前盐酸、氢氧化钠溶液的温度及二者混合反应后溶液的温度,故至少需使用3次;(3)①反应以不足量的HCl为标准计算,n(HCl)=n(H2O)=0.5mol/L×0.05L=0.025mol,Q=cm△t=4.18J/(g℃)×100g×(18.3-15)℃=1379.4J,则△H1=-1379.4J÷0.025mol=-55176J/mol≈-55.2kJ/mol;②根据以上分析可知第二组实验中Q=cm△t=4.18J/(g℃)×100g×(18-15)℃=1254J,则△H2=-1254J÷0.025mol=-50160J/mol≈-50.2kJ/mol,所以该反应的热化学方程式是HCl(aq)+NH3H2O(aq)=NH4Cl(aq)+H2O(l)△H2=-50.2kJ/mol;③反应热是酸、碱发生中和反应产生1mol水放出的热量。由于NH3H2O是弱碱,存在电离平衡,电离需要吸收热量,故反应产生1mol水放出的热量比强碱NaOH少。④根据以上分析可知碱溶液过量的原因是使酸完全反应。