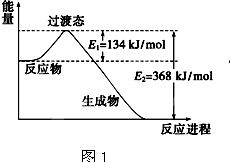
题目内容
【题目】探究氨气及铵盐性质的过程中,下列根据实验现象得出的结论不正确的是( )
A. 将集有氨气的试管倒扣于水槽中,液体迅速充满试管,说明氨气极易溶于水
B. 将pH=11的氨水稀释1000倍,测得pH>8,说明NH3·H2O为弱碱
C. 加热NH4HCO3固体,观察到固体逐渐减少,试管口有液滴产生,说明NH4HCO3受热不稳定
D. 将红热的Pt丝伸入右图所示的锥形瓶中,瓶口出现少量红棕色气体,说明氨气的氧化产物为NO2
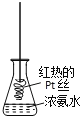
【答案】D
【解析】氨气极易溶于水生成氨水,所以将集有氨气的试管倒扣于水槽中液体迅速充满试管,故A正确; pH=11的氨水中![]() mol/L,稀释1000倍,测得pH>8,
mol/L,稀释1000倍,测得pH>8, ![]() mol/L,说明NH3·H2O的电离平衡正向移动,所以NH3·H2O为弱碱,故B正确;碳酸氢铵加热分解为氨气、二氧化碳、水,故C正确;氨气的氧化产物为NO,NO在锥形瓶口与氧气反应生成NO2,所以瓶口出现少量红棕色气体,故D错误。
mol/L,说明NH3·H2O的电离平衡正向移动,所以NH3·H2O为弱碱,故B正确;碳酸氢铵加热分解为氨气、二氧化碳、水,故C正确;氨气的氧化产物为NO,NO在锥形瓶口与氧气反应生成NO2,所以瓶口出现少量红棕色气体,故D错误。

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案【题目】已知在稀溶液中,强酸跟强碱发生中和反应生成1mol水时的反应热叫做中和热。现利用如图装置进行中和热的测定,请回答下列问题:

(1)图中缺少的仪器或用品有______、______。
(2)做一次完整的中和热测定实验,温度计需使用_____次。
(3)把温度为15.0℃,浓度为0.5mol/L的酸溶液和0.55mol/L的碱溶液各50mL混合(溶液密度均为1g/mL),生成溶液的比热容c=4.18 J·g-1·℃-1,轻轻搅动,测得酸碱混合液的温度变化数据如下:
反应物 | 起始温度t1/℃ | 终止温度t2/℃ | 中和热 |
HCl+NaOH | 15.0 | 18.3 | △H1 |
HCl+NH3·H2O | 15.0 | 18.0 | △H2 |
①计算表格中第一组实验测出的中和热△H1=______(保留一位小数)。
②写出表格中第二组实验的热化学方程式:_______________(保留一位小数)。
③两组实验结果差异的原因是________________。
④碱溶液过量的原因是___________。