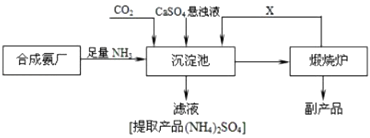
题目内容
【题目】下列叙述正确的是( )
A.1 mol O的质量是 32g/mol
B.OH﹣的摩尔质量是17g
C.1mol H2O的质量是18g/mol
D.CO2的摩尔质量是44g/mol
【答案】D
【解析】A.质量的单位为g,1mol氧原子的质量为16g,A不符合题意;
B.氢氧根离子的摩尔质量为17g/mol,g为质量的单位,B不符合题意;
C.1mol水的质量为18g,C不符合题意;
D.摩尔质量的单位为g/mol,二氧化碳的摩尔质量为44g/mol,D符合题意;
所以答案是:D.

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案【题目】为倡导“节能减排”和“低碳经济”,目前工业上有一种方法是用CO2来生产燃料乙醇。一定条件下发生反应:2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g) ΔH<0。
CH3CH2OH(g)+3H2O(g) ΔH<0。
(1)在一定条件下,在20 L密闭容器中按物质的量比为1∶3充入CO2和H2,温度在450 K,n(H2)随时间变化如表所示:
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8 | 6 | 5 | 5 |
在450 ℃、0~1 min,v(CH3CH2OH)=________;此温度下该反应的化学平衡常数为________(结果保留三位有效数字)。
(2)在5 MPa下测得平衡体系中各物质的体积分数随温度的变化曲线如图所示:

曲线乙表示的是 ________(填物质的化学式)的体积分数,图像中A点对应的体积分数b=________%(结果保留三位有效数字)。
(3)下列措施中能使化学平衡向正反应方向移动的是________。
A.升高温度
B.将CH3CH2OH(g)及时液化抽出
C.选择高效催化剂
D.再充入l mol CO2和3 mol H2
(4)25 ℃、1.01×105Pa时,9.2 g液态乙醇完全燃烧,当恢复到原状态时,放出273.4 kJ的热量,写出表示乙醇燃烧的热化学方程式:________________________。
(5)以石墨为电极,氢氧化钠、乙醇、水、氧气为原料,可以制成乙醇的燃料电池,写出发生还原反应的电极反应式:_____________________________________。
【题目】已知在稀溶液中,强酸跟强碱发生中和反应生成1mol水时的反应热叫做中和热。现利用如图装置进行中和热的测定,请回答下列问题:
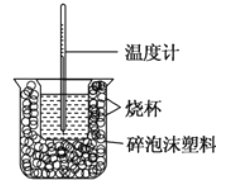
(1)图中缺少的仪器或用品有______、______。
(2)做一次完整的中和热测定实验,温度计需使用_____次。
(3)把温度为15.0℃,浓度为0.5mol/L的酸溶液和0.55mol/L的碱溶液各50mL混合(溶液密度均为1g/mL),生成溶液的比热容c=4.18 J·g-1·℃-1,轻轻搅动,测得酸碱混合液的温度变化数据如下:
反应物 | 起始温度t1/℃ | 终止温度t2/℃ | 中和热 |
HCl+NaOH | 15.0 | 18.3 | △H1 |
HCl+NH3·H2O | 15.0 | 18.0 | △H2 |
①计算表格中第一组实验测出的中和热△H1=______(保留一位小数)。
②写出表格中第二组实验的热化学方程式:_______________(保留一位小数)。
③两组实验结果差异的原因是________________。
④碱溶液过量的原因是___________。