题目内容
15.铁和锌合金8.85克溶于稀硫酸中,充分反应后得到氢气0.15mol,求合金中铁的质量.分析 据铁、锌与硫酸反应方程式,合金质量和生成氢气的质量进行计算.
解答 解:设合金中铁的质量是x,则锌的质量是8.85g-x,铁生成氢气的质量是a,锌生成氢气的质量是b
Fe+H2SO4═FeSO4+H2↑
56 2
x a
$\frac{56}{2}$=$\frac{x}{a}$,a=$\frac{x}{28}$
Zn+H2SO4═ZnSO4+H2↑
65 2
8.85g-x b
$\frac{65}{2}=\frac{8.85-x}{b}$,b=$\frac{2(8.85-x)}{65}$,则有$\frac{x}{28}$+$\frac{2(8.85-x)}{65}$=0.3,解得x=5.6g,则铁的质量是5.6g,锌的质量是8.85g-5.6g=3.25g;
答:合金中铁的质量为5.6g.
点评 掌握金属和酸反应的方程式,并能结合题意灵活分析解答,较简单.

练习册系列答案
相关题目
6.某空瓶质量为20克.在相同状况下,装满氧气称其质量为21克,若装满A气体,称其质量为22克,则A的相对分子质量是( )
| A. | 16 | B. | 32 | C. | 64 | D. | 128 |
10.下列对于如图装置叙述正确的是( )
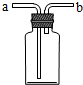

| A. | 若要除去CO中的CO2,可以装入氢氧化钠溶液,气体从b管进a管出 | |
| B. | 该装置若装满水可以用于排水法收集气体 | |
| C. | 该装置不可用于浓硫酸干燥H2气体 | |
| D. | 用排水法收集气体时,气体从a管进b管出 |
20.X、Y、M、N是短周期且原子序数依次增大的主族元素.已知X的最外层电子数是电子层数的3倍,X、M同主族,Y的原子在短周期主族元素中原子半径最大.下列有关说法正确的是( )
| A. | M、N的简单离子半径:r(N-)>r(M2-) | |
| B. | 气态氢化物的稳定性:M>X | |
| C. | X、Y形成的化合物中只有离子键 | |
| D. | X、Y、N所形成化合物的水溶液可能显中性或碱性 |
7.W、X、Y、Z均为短周期主族元素.Y的原子序数是W和Z的原子序数之和的一半,且其原子的最外层电子数与核外电子总数之比为2:7,W和Z形成的可溶性化合物WZ溶于水不能促进水的电离,W、X、Z三种元素形成的某种常见化合物M能消毒,下列说法正确的是( )
| A. | Y与Z形成的化合物中含 有离子键 | |
| B. | W、X、Z的简单离子中半径最大的是W | |
| C. | M的水溶液呈碱性 | |
| D. | 1molW单质与足量X单质反应,转移电子物质的量可能是2mol,也可能是1mol |
4.下列事实中,不能用勒夏特列原理解释的是( )
| A. | 加压有利于SO2与O2反应生成SO3 | |
| B. | 实验室中常用排饱和食盐水的方式收集氯气 | |
| C. | 打开汽水瓶,有气泡从溶液中冒出 | |
| D. | 500℃左右比常温下更有利于合成氨 |
5.近年来,加“碘”食盐较多的使用了碘酸钾(KIO3),碘酸钾在工业上可用电解法制取.以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应方程式为:KI+3H2O$\frac{\underline{\;电解\;}}{\;}$ KIO3+3H2↑.下列有关说法正确的是( )
| A. | 电解时,石墨作阴极,不锈钢作阳极 | |
| B. | 电解时,阳极反应是:I--6e-+3H2O=IO3-+6H+ | |
| C. | 溶液调节至强酸性,对生产有利 | |
| D. | 电解前后溶液的pH几乎不变 |