题目内容
5.在实验室里,某同学取一小块金属钠做与水反应的实验.试完成下列问题:(1)将钠投入水中后,钠融化成一个小球,根据这一现象你能得出的结论是:钠与水反应放出热量 钠的熔点低
(2)将一小块钠投入盛有饱和石灰水的烧杯中,不可能观察到的现象是C(填编号).
A.有气体生成 B.钠融化成小球并在液面上游动
C.溶液底部有银白色的金属钙生成 D.溶液变浑浊.
分析 (1)依据钠与水反应放出大量的热及钠的熔点低解答;
(2)钠投入盛有饱和石灰水的烧杯中,钠和水反应生成氢氧化钠和氢气,随着反应的进行水的量减少,氢氧化钙溶液成为过饱和溶液,溶液中析出部分氢氧化钙,因为有氢氧化钠的存在,抑制氢氧化钙的溶解;
解答 解:(1)钠与水反应放出大量的热及钠的熔点低,所以将钠投入水中后,钠融化成一个小球,
故答案为:钠与水反应放出热量 钠的熔点低;
(2)钠投入盛有饱和石灰水的烧杯中,钠和水反应生成氢氧化钠和氢气,随着反应的进行水的量减少,氢氧化钙溶液成为过饱和溶液,溶液中析出部分氢氧化钙,因为有氢氧化钠的存在,抑制氢氧化钙的溶解,所以能够看到的现象为:钠融化成小球并在液面上游动,有气泡冒出,溶液变浑浊;
故选:C.
点评 本题考查了钠与水、碱溶液反应,明确钠的性质是解题关键,注意钠与石灰水反应的实质是先与水反应生成氢氧化钠和氢气,题目难度不大.

练习册系列答案
相关题目
16.分子中含有4个甲基的C6H14,其一氯代物的同分异构体共有(不考虑立体异构)( )
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
13.现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复).
(1)
(2)写出E溶液与过量的B溶液反应的离子方程式:2Al3++3SO42-+3Ba2++8OH-═2AlO2-+4H2O+3BaSO4↓.
(3)在100mL 0.1mol•L-1E溶液中,逐滴加入35mL 2mol•L-1NaOH溶液,写出发生反应的离子方程式2Al3++7OH-=Al(OH)3↓+AlO2-+2H2O.
| 阳离子 | H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 | OH-、Cl-、CO${\;}_{3}^{2-}$、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ |
| 物质鉴定试验 | 推导结论 |
| ①用pH试纸测出A、B溶液呈碱性,C、D、E溶液呈酸性 | A、B中含有的阴离子为CO32-、OH-,C、D、E中含有的阳离子为H+、Al3+、Ag+ |
| ②A溶液与E溶液反应,既有气体产生又有沉淀产生,A与C反应只有气体产生 | A为Na2CO3,C含H+ |
| ③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀 | D为AgNO3 |
(3)在100mL 0.1mol•L-1E溶液中,逐滴加入35mL 2mol•L-1NaOH溶液,写出发生反应的离子方程式2Al3++7OH-=Al(OH)3↓+AlO2-+2H2O.
20.能正确表示下列反应的离子方程式是( )
| A. | 金属钠和水反应 2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 将四氧化三铁溶于盐酸:Fe3O4+8H+═3Fe3++4H2O | |
| C. | 将过量铁粉和稀硝酸混合:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| D. | 将铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ |
10.用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 4g 氦气中含有的分子数为NA | |
| B. | 常温常压下,22.4LCl2中含有的分子数为NA | |
| C. | 1L1mol/LK2SO4溶液中含有的钾离子数为NA | |
| D. | 1mol钠原子中含有的电子数为NA |
14.设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 2.4g金属镁变为镁离子时失去的电子数为0.1NA | |
| B. | 1.8g的NH4+离子中含有的电子数为NA | |
| C. | 11.2 L氧气所含的原子数为NA | |
| D. | 常温常压下,48gO3和O2的混合气体中含有的氧原子数为2NA |
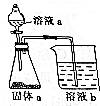 如图是中学化学常见的装置,可用该装置验证元素非金属性的强弱.
如图是中学化学常见的装置,可用该装置验证元素非金属性的强弱.