题目内容
【题目】利用氨气脱硝![]() 除
除![]() 是大气污染防治研究的热点,脱硝过程中涉及的反应为:
是大气污染防治研究的热点,脱硝过程中涉及的反应为:
主反应:![]()
副反应:
①4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905.5KJ/mol
②4NH3(g)+4O2(g)=2N2O(g)+6H2O(g) △H=-1104.9KJ/mol
③4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H=-1269.0KJ/mol
回答下列问题:
(1)主反应的△H为______
(2)如图所示,保持其它条件相同,使用两种不同的催化剂,主反应NO的转化率与温度关系如图所示:
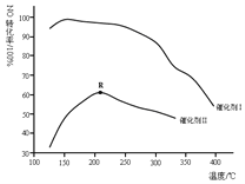
①选用催化剂I的优势有______![]() 写出一点
写出一点![]()
②R点对应的温度为2100C,低于2100C,NO的转化率是不是对应温度下的平衡转化率,请作出判断并写出理由______.
(3)常温下,在通入氧气的条件下用![]() 的NaOH溶液吸收NO也可实现脱硝
的NaOH溶液吸收NO也可实现脱硝![]() 产物主要为
产物主要为![]() 和
和![]() ,已知反应后溶液的
,已知反应后溶液的![]() ,溶液中
,溶液中![]() 浓度为5.6×10-2mol/L,忽略反应过程中溶液体积变化,
浓度为5.6×10-2mol/L,忽略反应过程中溶液体积变化,![]() 的电离平衡常数为5.1×10-4,则:
的电离平衡常数为5.1×10-4,则:
①c(NO2-)c(OH-)/c(HNO2)=______![]()
②某溶液中c(NO2-)=1.0×10-6mol/L,取该溶液5mL,加入一滴![]() 的硝酸银溶液
的硝酸银溶液![]() 一滴为
一滴为![]() ,通过计算说明能否产生沉淀______[Ksp(AgNO2)=2×10-8]
,通过计算说明能否产生沉淀______[Ksp(AgNO2)=2×10-8]
【答案】-![]() 催化剂I在低温下就能使主反应NO的转化率很高,若使用此催化剂脱硝,更有利于节约能源 低于210℃时,NO的转化率随温度升高而增大,而主反应为放热反应,升高温度向逆反应进行,则NO的平衡转化率应随温度升高而降低,与平衡移动得到的结论不一致,故该温度范围内NO的转化率都是非平衡转化率 5.1×106 不能
催化剂I在低温下就能使主反应NO的转化率很高,若使用此催化剂脱硝,更有利于节约能源 低于210℃时,NO的转化率随温度升高而增大,而主反应为放热反应,升高温度向逆反应进行,则NO的平衡转化率应随温度升高而降低,与平衡移动得到的结论不一致,故该温度范围内NO的转化率都是非平衡转化率 5.1×106 不能
【解析】
(1)主反应的△H可利用盖斯定律由副反应求得;
(2)观察图可知,温度低于400℃时,催化剂I催化效率明显比催化剂II高;催化剂II的催化效率先增后减。由于催化剂对平衡转化率没有影响,所以可先根据主反应的热效应判断温度高于210℃时是否达到平衡,再结合图形判断温度低于210℃时是否达到平衡。
(3) ①可借助![]() 的电离平衡常数和水的电离常数来计算
的电离平衡常数和水的电离常数来计算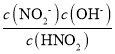 的值;②可根据离子积和溶度积的关系判断沉淀能否生成。
的值;②可根据离子积和溶度积的关系判断沉淀能否生成。
(1)根据盖斯定律,由三个副反应可计算主反应的ΔH=③![]() 2-①=-1269.0KJ/mol
2-①=-1269.0KJ/mol![]() 2-(-905.5KJ/mol)= -1632.5kJ/mol。答案为:-1632.5kJ/mol;
2-(-905.5KJ/mol)= -1632.5kJ/mol。答案为:-1632.5kJ/mol;
(2) ①观察图可知,温度低于400℃时,催化剂I催化效率明显比催化剂II高,且在更低温度(150℃左右)催化效率更高,有利于节约能源;答案为:催化剂I在低温下就能使主反应NO的转化率很高,若使用此催化剂脱硝,更有利于节约能源;
②根据计算结果可知,主反应为放热反应,所以如果反应达到平衡,升高温度将向逆反应进行,NO的平衡转化率降低。而观察图象可知,低于210℃时,NO的转化率随温度升高而增大,与平衡移动得到的结论不一致,所以反应未达平衡。答案为:低于210℃时,NO的转化率随温度升高而增大,而主反应为放热反应,升高温度向逆反应进行,则NO的平衡转化率应随温度升高而降低,与平衡移动得到的结论不一致,故该温度范围内NO的转化率都是非平衡转化率;
(3)①由HNO2![]() H++NO2-,有:
H++NO2-,有:![]() ,则:
,则:![]() 。答案为:5.1×106
。答案为:5.1×106
②滴入硝酸银溶液后:c(NO2-)≈1.0×10-6mol/L,![]() ≈1.0×10-3mol/L,浓度商Qc=c(NO2-)×c(Ag+)≈ 1.0×10-6×1.0×10-3=1.0×10-9<Ksp(AgNO2),故不能生成沉淀;答案为:不能。
≈1.0×10-3mol/L,浓度商Qc=c(NO2-)×c(Ag+)≈ 1.0×10-6×1.0×10-3=1.0×10-9<Ksp(AgNO2),故不能生成沉淀;答案为:不能。

 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案【题目】某兴趣小组研究含铁元素的盐类物质的制备、保存和性质。
实验I. 配制FeCl2溶液:向0.1 mol·L-1 FeCl3溶液中加入足量铁粉,充分振荡,备用。
(1)FeCl3溶液与铁粉反应的离子方程式是__________。
(2)在老师的指导下,配制的FeCl2溶液底部仍保留一层铁粉,请说明该操作的必要性__________。
实验II. 通过Fe(NO3)2的性质实验,探究试剂添加顺序的不同对现象和反应的影响。
实验 | 试剂及操作 | 现象 | |
试管 | 滴管 | ||
| 0.1 mol/L Fe(NO3)2溶液 | 实验i: 先滴加1.0 mL 0.5 mol·L-1 NaOH溶液; 再滴加1.5mL 1.0 mol·L-1 H2SO4溶液 | i. 滴加NaOH溶液后__________;加酸后溶液变为黄色 |
实验ii: 先滴加1.5 mL 1.0 mol·L-1 H2SO4溶液; 再滴加1.0 mL 0.5 mol·L-1 NaOH溶液 | ii. 加酸时溶液无明显现象;加碱后溶液依然没有明显变化 | ||
(3)实验i中滴加NaOH溶液后出现的一系列现象是__________;请用化学或离子方程式说明Fe(NO3)2溶液中滴加碱溶液后出现此系列现象的原因__________、__________。
(4)探究实验ii中先滴加H2SO4溶液时Fe(NO3)2溶液中是否发生了反应:
A. 向1.0 mL 0.1 mol·L-1 Fe(NO3)2溶液中__________(填写具体实验方法),溶液立即变红,说明加酸时溶液中发生了反应,生成了Fe3+。
B. 推测溶液中产生Fe3+的可能原因有两种:
a. 酸性条件下,__________;
b. 酸性条件下,Fe2+可能被空气中的O2氧化,写出相应的离子方程式:___________。