题目内容
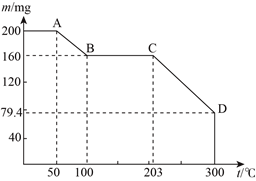
【题目】下图是200mg MnC2O4·2H2O晶体放在坩埚里加热分解时,所得固体产物的质量(m)随温度(t)变化的关系曲线。(已知草酸锰不稳定,但其中锰元素的化合价在300℃以下不变)
试回答下列问题:
(1)写出B点固体产物的化学式________________________________________;
(2)通过计算确定D点处产物的化学式______________________________。
(3)NaBH4(s)与H2O(l)反应生成NaBO2(s)和H2(g),在25 ℃、101 kPa下,已知每消耗3.8 g NaBH4(s)放热21.6 kJ,该反应的热化学方程式是_____________________________________________。
(4)降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸。
已知:2NO2(g)![]() N2O4(g) ΔH1 2NO2(g)
N2O4(g) ΔH1 2NO2(g)![]() N2O4(l) ΔH2
N2O4(l) ΔH2
下列能量变化示意图中,正确的是(选填字母)________。

(5)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25 ℃、101 kPa下,已知该反应每消耗1 mol CuCl(s),放热44.4 kJ,该反应的热化学方程式是_______________________________。
【答案】 MnC2O4 MnO NaBH4(s)+2H2O(l)===NaBO2(s)+4H2(g) ΔH=-216 kJ/mol A 4CuCl(s)+O2(g)===2CuCl2(s)+2CuO(s) ΔH=-177.6 kJ·mol-1
【解析】(1)200mg MnC2O 4·2H2O中结晶水的质量为![]() ×200mg=40 mg,则MnC2O4的质量为160mg,因此B点固体产物的化学式为MnC2O4,故答案为:MnC2O4;
×200mg=40 mg,则MnC2O4的质量为160mg,因此B点固体产物的化学式为MnC2O4,故答案为:MnC2O4;
(2)200mg MnC2O 4·2H2O的物质的量为![]() =
=![]() mmol,假如1molD中含有1molMn,则D的摩尔质量=
mmol,假如1molD中含有1molMn,则D的摩尔质量=![]() =
=![]() mmol,解得M=71g/mol,因此化学式为MnO,并且满足锰元素的化合价在300℃以下不变,均为+2价,故答案为:MnO;
mmol,解得M=71g/mol,因此化学式为MnO,并且满足锰元素的化合价在300℃以下不变,均为+2价,故答案为:MnO;
(3)NaBH4(s)与H2O(l)反应生成NaBO2(s)和H2(g),n(NaBH4)= ![]() =0.1mol,在25℃、101kPa下,每消耗0.1molNaBH4(s)放热21.6kJ,则消耗1molNaBH4(s)放热216.0kJ,则热化学方程式为NaBH4(s)+2H2O(l)=NaBO2(s)+4H2(g)△H=-216.0kJ/mol,故答案为:NaBH4(s)+2H2O(l)=NaBO2(s)+4H2(g)△H=-216.0kJ/mol;
=0.1mol,在25℃、101kPa下,每消耗0.1molNaBH4(s)放热21.6kJ,则消耗1molNaBH4(s)放热216.0kJ,则热化学方程式为NaBH4(s)+2H2O(l)=NaBO2(s)+4H2(g)△H=-216.0kJ/mol,故答案为:NaBH4(s)+2H2O(l)=NaBO2(s)+4H2(g)△H=-216.0kJ/mol;
(4)降低温度,将NO2(g)转化为N2O4(l)说明反应2NO2(g)N2O4(l)为放热反应,所以在图象中该反应的反应物的总能量比生成物的总能量高,同种物质气态变液态会放出热量,即液态时能量比气态时能量低,则N2O4(l)具有的能量比N2O4(g)具有的能量低,图象A符合,故A正确;故答案为:A;
(5)每消耗1molCuCl(s),放热44.4kJ,则4molCuCl反应放出热量为44.4kJ×4=177.6kJ,则热化学方程式为4CuCl(s)+O2(g)═2CuCl2(s)+2CuO(s)△H=-177.6kJmol-1,
故答案为:4CuCl(s)+O2(g)═2CuCl2(s)+2CuO(s)△H=-177.6kJmol-1。

 考前必练系列答案
考前必练系列答案