题目内容
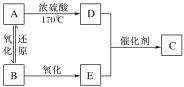
【题目】一定条件下A、B、C的如图所示的转化关系,且△H=△H1+△H2。则A、C可能是( )
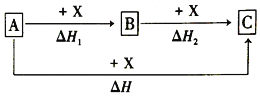
①Fe、FeCl3②C、CO2③AlCl3、NaAlO2④NaOH、NaHCO3⑤S、SO3⑥Na2CO3、CO2
A.②③④⑥B.②③④⑤⑥
C.①②③④⑥D.①②③④⑤⑥
【答案】A
【解析】
①若A为Fe,与Cl2反应一定生成FeCl3,而FeCl3与Cl2不能再反应,①不合题意;
②若A为C,则与O2反应生成CO,CO与O2反应生成CO2,C与O2反应也可直接生成CO2,②符合题意;
③若A为AlCl3,与NaOH溶液反应生成Al(OH)3,Al(OH)3与NaOH反应生成NaAlO2,Al与NaOH溶液反应也可直接生成NaAlO2,③符合题意;
④若A为NaOH,与CO2反应生成Na2CO3,Na2CO3与CO2、水反应生成NaHCO3,NaOH溶液中通入过量CO2也可直接生成NaHCO3,④符合题意;
⑤若A为S,则与O2反应生成SO2,SO2与O2在催化剂作用下反应生成SO3,但S与O2反应不能直接生成SO3,⑤不合题意;
⑥若A为Na2CO3,则与HCl反应生成NaHCO3,NaHCO3再与HCl反应生成CO2,Na2CO3与过量HCl反应也可直接生成CO2,⑥符合题意;
综合以上分析,②③④⑥符合题意,故选A。

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案【题目】Ⅰ.用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
实验序号 | A溶液 | B溶液 |
① | 20mL0.1mol·L-1H2C2O4溶液 | 30mL0.1 mol·L-1KMnO4溶液 |
② | 20mL0.2mol·L-1H2C2O4溶液 | 30mL0.1mol·L-1KMnO4溶液 |
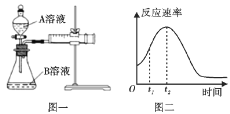
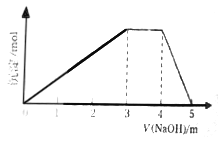
(1)该实验探究的是___因素对化学反应速率的影响。如图一,相同时间内针筒中所得的CO2体积大小关系是___(填实验序号)。
(2)若实验①在2min末收集了2.24mLCO2(标准状况下),则在2min末,c(MnO4-)__mol·L-1(假设混合液体积为50mL)。
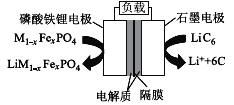
Ⅱ.一定温度下,将一定量的N2和H2充入固定体积的密闭容器中进行反应:N2(g)+3H2(g)![]() 2NH3(g)。
2NH3(g)。
下列描述能说明该可逆反应达到化学平衡状态的有___。
A.容器内的压强不变
B.容器内气体的密度不变
C.相同时间内有3mol H-H键断裂,有6mol N-H键形成
D.c(N2):c(H2):c(NH3)=1:3:2
E.NH3的质量分数不再改变
【题目】一种通过铁基氧载体(Fe3O4/FeO)深度还原和再生来合成二甲醚(CH3OCH3) 的原理如图:
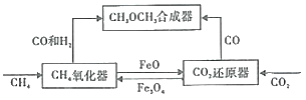
(1)CH4氧化器中发生的主反应:
i.CH4(g)+Fe3O4(s)=CO(g)+2H2(g)+3FeO(s)
ii.CH4(g)+4Fe3O4(s)=CO2(g)+2H2O(g)+12FeO(s)
850℃时,压强和部分气体体积分数、固相各组分质量分数的关系如图。
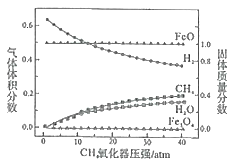
①随着压强的增大,反应i的平衡常数K值___(填“增大”、“减小”或“不变”)。
②结合图像,分析H2O的体积分数变化的原因___(用化学方程式表示)。
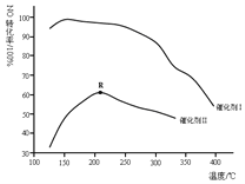
(2)将一定量的FeO和CO2置于CO2还原器(体积不变的密闭容器)中,发生的主反应:CO2(g)+3FeO(s)=Fe3O4(s)+CO(g)。保持其他条件不变,测得不同温度下最终反应体系中CO、CO2体积分数如表。
温度t/℃ | 100 | 170 | 200 | 300 | 400 | 500 |
CO2体积分数 | 0.67 | 0.67 | 0.75 | 0.82 | 0.9 | 0.92 |
CO体积分数 | 0.33 | 0.33 | 0.25 | 0.18 | 0.1 | 0.08 |
①△H2___0(填“>”或“<”)。
②由上表可知,若在150℃时进行上述转化,理论转化率α(FeO)为100%。在上述反应体系中,一定可以说明该反应达到平衡状态的是___(填标号)。
A.CO2的物质的量不变 B.体系的压强不变
C.气体的平均摩尔质量不变 D.CO的生成速率和消耗速率相等且不等于零
③根据化学反应原理,分析CO2还原器温度设置在170℃的原因___。