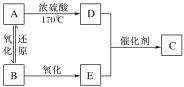
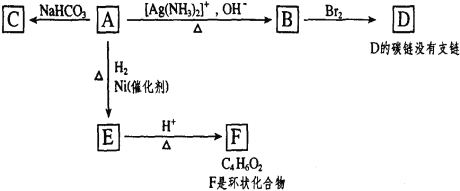
题目内容
【题目】常温下,用0.1000molL-1NaOH溶液滴定20.00mL 0.1000molL-1CH3COOH溶液所得滴定曲线如图:
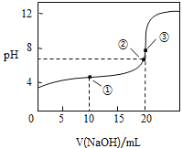
(1)在整个实验过程中,不需要的仪器是 ______ (填序号).
a.100mL容量瓶 b.锥形瓶 c.滴定管夹 d.漏斗 e.玻璃棒 f.滴定管
(2)点②所示溶液为中性:c(Na+)________c(CH3COO-)(填“>”“<”或“=”)。
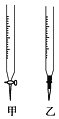
(3)盛装标准NaOH溶液选择图中滴定管_________(填标号)。
(4)滴定时边滴边摇动锥形瓶,眼睛应注意观察____________。
(5)下列操作会导致测定结果偏低的是______。
A.碱式滴定管在装液前未用标准NaOH溶液润洗
B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出
C.碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数
(6)氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:
①可将4mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20mL l.0×l0-4mol/L的KMnO4溶液。
Ⅰ、滴定终点的现象是_________________________________。
Ⅱ、计算:血液中含钙离子的浓度为______mol/L。
【答案】ade = 乙 锥形瓶内溶液颜色的变化 BC 当滴入最后一滴酸性KMnO4溶液后溶液由无色变为浅紫色,且半分钟内不褪色 1. 25×10-3
【解析】
(1)根据滴定装置选择仪器;
(2)根据溶液电荷守恒分析;
(3)盛装标准NaOH溶液要用碱式滴定管;
(4)滴定时边滴边摇动锥形瓶,为了在终点时及时停止,眼睛应注意观察锥形瓶内溶液颜色的变化。
(5)根据关系式c(待测)×V(待测)=c(标准)×V(标准);
(6)滴定终点,溶液颜色变化,且半分钟内颜色不变;
根据5CaC2O4~5H2C2O4~2MnO4-计算;
(1)根据滴定装置要用到滴定架、滴定管夹、锥形瓶、滴定管,在整个实验过程中,不需要的仪器是 a.100mL容量瓶d.漏斗 e.玻璃棒 故选ade;
(2)点②所示溶液为中性:根据溶液电荷守恒:c(H+)+c(Na+)=c(CH3COO-)+c(OH-),c(H+)=c(OH-),则c(Na+)=c(CH3COO-);
(3)盛装标准NaOH溶液要用碱式滴定管,选择图中滴定管乙;
(4)滴定时边滴边摇动锥形瓶,为了在终点时及时停止,眼睛应注意观察锥形瓶内溶液颜色的变化。
(5)A.碱式滴定管在装液前未用标准NaOH溶液润洗,会导致标准NaOH溶液浓度变小,体积偏大,测量结果偏大,故A不符;
B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出,会导致所需标准液偏小,测量结果偏小,故B符合;
C.碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡,会导致体积读数偏小,测量结果偏小,故C符合;
D.达到滴定终点时,仰视读数,会导致体积偏大,测量结果偏大,故D不符;
故选BC;
(6)Ⅰ、滴定终点的现象是当最后一滴KMnO4溶液滴入后,溶液由无色变为红色,且半分钟不褪色;
Ⅱ、5CaC2O4~5H2C2O4~2MnO4-
5mol 5mol 2mol
c(Ca2+)4×10-3L l.0×l0-4mol·L-1×20×10-3L
则血液中含钙离子的浓度为c(Ca2+)=1. 25×10-3mol·L-1。

【题目】铅蓄电池是常用的化学电源,其电极材料分别是Pb和PbO2,电解液为稀硫酸。放电时,该电池总反应式为:Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O。请根据上述情况判断:
2PbSO4+2H2O。请根据上述情况判断:
(1)该蓄电池的负极材料是_________,放电时发生_________(填“氧化”或“还原”)反应。
(2)该蓄电池放电时,电解质溶液的酸性_________(填“增大”、“减小”或“不变”)。
(3)已知硫酸铅为不溶于水的白色固体,生成时附着在电极上。试写出该电池放电时,正极的电极反应_______________________________________(用离子方程式表示)。
(4)氢氧燃料电池具有启动快、效率高等优点,其能量密度高于铅蓄电池。若电解质为H2SO4溶液,则氢氧燃料电池的正极反应式为__________________________________。
(5)铅的电解精炼是工业上实现废铅回收以及粗铅提纯的重要手段。铅的电解精炼在由PbSiF6和H2SiF6两种强电解质组成的水溶液中进行。从还原炉中产出的某粗铅成分如下表所示:
成分 | Pb | Cu | Ag | Fe | Zn | Sn | 其它 |
% | 97.50 | 1.22 | 0.12 | 0.15 | 0.09 | 0.64 | 0.28 |
①电解精炼时阳极泥的主要成分是______(元素符号)。
②电解过程中,粗铅表面会生成SiF6气体,写出该电极反应式________。