题目内容
4.已知某温度时0.01mol/L HAc的电离度是4.24%,求其电离平衡常数和[H+].分析 电离度=$\frac{电离浓度}{原浓度}$×100%,所以4.24%=$\frac{c({H}^{+})}{0.01}$,据此分析计算.
解答 解:电离度=$\frac{电离浓度}{原浓度}$×100%,所以4.24%=$\frac{c({H}^{+})}{0.01}$,c(H+)=4.24×10-4mol/L,则c(Ac-)=4.24×10-4mol/L,电离平衡时c(HAc)=0.01mol/L-4.24×10-4mol/L,所以醋酸的电离平衡常数K=$\frac{[{H}^{+}]•[A{c}^{-}]}{[HAc]}$=$\frac{4.24×1{0}^{-4}×4.24×1{0}^{-4}}{0.01-4.24×1{0}^{-4}}$=1.8×10-5,故答案为:醋酸的电离平衡常数为1.8×10-5;[H+]=4.24×10-4mol/L.
点评 本题考查了弱酸的电离平衡常数的计算和离子浓度的计算,题目难度不大.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
15.下列图象表达正确的是( )
| A. | 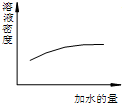 浓硫酸的稀释 浓硫酸的稀释 | |
| B. | 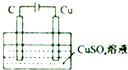 某电极上有铜产生,且溶液中铜离子浓度不变 | |
| C. |  微粒电子数 微粒电子数 | |
| D. | 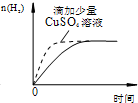 过量的盐酸和等量的锌粉反应 过量的盐酸和等量的锌粉反应 |
19.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、Na+、SiO32-、NO3- | |
| B. | 0.1 mol•L-1 Na2CO3溶液:K+、Fe3+、NO3-、Cl- | |
| C. | 0.1 mol•L-1NaClO溶液:Na+、NH4+、SO32-、CO32- | |
| D. | 0.1 mol•L-1Na[Al(OH)4]溶液:K+、Na+、SO42-、HCO3- |
3.某有机物A的分子式为C10H14O,已知A为芳香族化合物,苯环含有两个取代基,苯环上的一溴代物只有两种;又知A既能发生催化氧化反应,又能发生消去反应.则A的结构共有( )
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
10.下列叙述错误的是( )
| A. | 砹化银难溶于水,见光容易分解 | |
| B. | H20、H2S、H2Se随着相对分子质量的增大,沸点逐渐升高 | |
| C. | 因为H2C03比H2Si03酸性强,所以将C02通入N2SiC3溶液中有H2Si03沉淀生成 | |
| D. | 铝和铊同属第IIIA族元素,但氢氧化铊[Tl(OH)3]不一定呈两性 |
7.下列离子方程式书写正确的是( )
| A. | 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| B. | AlCl3溶液中加过量氨水:Al3++4NH3•H2O═AlO2-↓+4NH4++2H2O | |
| C. | 小苏打置于盐酸中:CO32-+2H+═CO2↑+H2O | |
| D. | 过量CO2通入漂白粉溶液中:CO2+H2O+ClO-═HCO3-+HClO |
8.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 2.3 g钠与水反应产生氢气的分子数为0.05NA | |
| B. | 1 mol Fe与过量的稀HNO3反应,转移2NA个电子 | |
| C. | 0.1 mol/LNa2SO4溶液含有0.1NA个SO42- | |
| D. | 22.4 L氯气与足量铜充分反应,生成1 mol CuCl2 |
 ;
;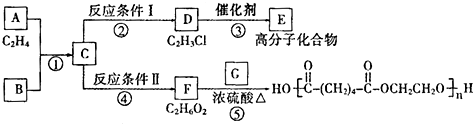
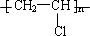 ,GHOOC(CH2)4COOH;
,GHOOC(CH2)4COOH;