题目内容
12.有机化学根据图示回答下列问题: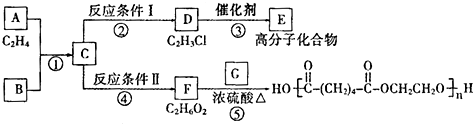
(1)写出结构简式:E
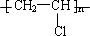 ,GHOOC(CH2)4COOH;
,GHOOC(CH2)4COOH;(2)写出反应类型:①加成反应,③加聚反应;
(3)写出化学方程式:②ClCH2H2Cl+NaOH$→_{△}^{C_{2}H_{5}OH}$CH2=CHCl+NaCl+H2O,④ClCH2H2Cl+2NaOH$→_{△}^{H_{2}O}$HOCH2CH2OH+2NaCl.
分析 A的分子式为C2H4,则A为:CH2=CH2,故①应为加成反应;D可发生反应生成高聚物E,由分子式可知D为:CH2=CHCl,E为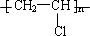 ;
;
由反应⑤可知F为HOCH2CH2OH、G为HOOC(CH2)4COOH,则C应为ClCH2H2Cl,是由CH2=CH2和氯气发生加成反应生成,ClCH2H2Cl发生消去反应生成D,发生水解反应生成F,以此解答该题.
解答 解:A的分子式为C2H4,可知A的结构简式为:CH2=CH2,故①应为加成反应,D可发生反应生成高聚物E,由分子式可知D为CH2=CHCl,E的结构简式为: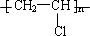 ,由反应⑤可知F为HOCH2CH2OH,G为HOOC(CH2)4COOH,则C应为ClCH2H2Cl,由CH2=CH2和氯气发生加成反应生成,
,由反应⑤可知F为HOCH2CH2OH,G为HOOC(CH2)4COOH,则C应为ClCH2H2Cl,由CH2=CH2和氯气发生加成反应生成,
(1)由以上分析可知E为: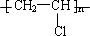 ,G为:HOOC(CH2)4COOH,
,G为:HOOC(CH2)4COOH,
故答案为:CH2=CH2;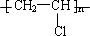 ;HOOC(CH2)4COOH;
;HOOC(CH2)4COOH;
(2)反应①为CH2=CH2与氯气的加成反应、③为CH2=CHCl的加聚反应,
故答案为:加成反应; 加聚反应;
(3)反应②为ClCH2H2Cl的消去反应,反应的方程式为:ClCH2H2Cl+NaOH$→_{△}^{C_{2}H_{5}OH}$CH2=CHCl+NaCl+H2O,
故答案为:ClCH2H2Cl+NaOH$→_{△}^{C_{2}H_{5}OH}$CH2=CHCl+NaCl+H2O;
反应④为ClCH2H2Cl的取代反应,反应方程式为:ClCH2H2Cl+2NaOH$→_{△}^{H_{2}O}$HOCH2CH2OH+2NaCl,
故答案为:ClCH2H2Cl+2NaOH$→_{△}^{H_{2}O}$HOCH2CH2OH+2NaCl.
点评 本题考查有机物的推断,为高频考点,题目难度中等,侧重于学生的分析能力的考查,题目以乙烯的加成反应为依托,考查了氯代烃的消去和水解,并考查了加聚和缩聚反应,根据官能团掌握物质的主要性质是解题关键.

| A. | 在酯水解试验中,可以通过观察酯层消失的时间差异,来判断乙酸乙酯在不同条件下水解速率的差别 | |
| B. | 探究“温度影响硫代硫酸钠与稀硫酸反应速率的因素”的实验中,需要用到的计量仪器只需量筒、温度计 | |
| C. | 在溴富集过程中,可在分液漏斗中加入4mL溴水,再向其中加入10mL四氯化碳,振荡,静置、分液,得下层液体 | |
| D. | 实验室制备乙烯常用硫酸铜溶液洗气 |
| A. | HD、H2O、NH3均为化合物 | |
| B. | CH2O2、C3H6O2、C4H8O2一定互为同系物 | |
| C. | HCOOCH3、CH3COOH、HOCH2CHO互为同分异构体 | |
| D. | SiO2、NaCl、S8、Cu均是能表示物质分子组成的分子式 |
| A. | 存在顺反异构 | B. | 经加聚反应得树脂 | ||
| C. | 属于盐类 | D. | 使酸性KMnO4溶液褪色 |
| A. | 上述四种元素的原子半径大小为W<X<Y<Z | |
| B. | Z元素的最高化合价为+7价 | |
| C. | W、X、Y、Z原子的核外最外层电子数的总和为17 | |
| D. | Y元素的最高价氧化物的对应水化物能溶解所有的金属 |
| A. | CH3COOCH2CH3+H2O $\stackrel{催化剂△}{→}$ CH3CH2OH+CH3COOH | |
| B. | CH2=CH2+HCl$→_{△}^{一定条件}$CH3CH2Cl | |
| C. | 2CH3CH2OH+O2$\stackrel{Cu}{→}$2CH3CHO+2H2O | |
| D. |  |
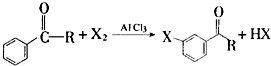


 +Br2$\stackrel{AlCl_{3}}{→}$
+Br2$\stackrel{AlCl_{3}}{→}$ +HBr
+HBr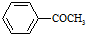 的符合以下条件的同分异构体还有4种(不包括原料本身),条件:结构中必须含有苯环和
的符合以下条件的同分异构体还有4种(不包括原料本身),条件:结构中必须含有苯环和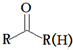 ,其中核磁共振氢谱图中共有5个吸收峰的分子的结构简式为
,其中核磁共振氢谱图中共有5个吸收峰的分子的结构简式为
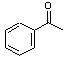
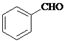 )和乙醇为原料合成苯乙酸乙酯,如图
)和乙醇为原料合成苯乙酸乙酯,如图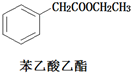 :
: (1)CH3+、-CH3(甲基)、CH3-都是重要的有机反应中间体,有关它们的说法正确的是CDE.
(1)CH3+、-CH3(甲基)、CH3-都是重要的有机反应中间体,有关它们的说法正确的是CDE.