题目内容
8.设NA为阿伏伽德罗常数的值,下列说法正确的是( )| A. | 2.3 g钠与水反应产生氢气的分子数为0.05NA | |
| B. | 1 mol Fe与过量的稀HNO3反应,转移2NA个电子 | |
| C. | 0.1 mol/LNa2SO4溶液含有0.1NA个SO42- | |
| D. | 22.4 L氯气与足量铜充分反应,生成1 mol CuCl2 |
分析 A.2.3g钠的物质的量为0.1mol,与水完全反应转移0.1mol的电子,生成0.05mol的氢气;
B.稀硝酸过量,铁完全反应生成铁离子;
C.缺少硫酸钠溶液的体积,无法计算溶液中的硫酸根离子数目;
D.没有告诉在标况下,不能使用标况下的气体摩尔体积计算.
解答 解:A.2.3g钠的物质的量为:$\frac{2.3g}{23g/mol}$=0.1mol,0.1mol钠完全反应失去0.1mol电子,根据电子守恒,生成氢气的物质的量为0.05mol,产生氢气的分子数为0.05NA,故A正确;
B.1 mol Fe与过量的稀HNO3反应生成1mol铁离子,失去3mol电子,转移3NA个电子,故B错误;
C.没有告诉硫酸钠溶液的体积,无法计算溶液中硫酸钠的物质的量及数目,故C错误;
D.不是标况下,不能使用标况下的气体摩尔体积计算22.4L氯气的物质的量,故D错误;
故选A.
点评 本题考查阿伏加德罗常数的应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下气体摩尔体积的使用条件;试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
19.用玻璃棒分别蘸取下列各项中的两种浓溶液,将玻璃棒的下端相互靠近,没有白烟生成的是( )
| A. | 浓氨水和浓HNO3 | B. | 浓氨水和浓盐酸 | C. | 浓氨水和浓H2SO4 | D. | 浓氨水和浓H3PO4 |
16.下列反应中,属于加成反应的是( )
| A. | CH3COOCH2CH3+H2O $\stackrel{催化剂△}{→}$ CH3CH2OH+CH3COOH | |
| B. | CH2=CH2+HCl$→_{△}^{一定条件}$CH3CH2Cl | |
| C. | 2CH3CH2OH+O2$\stackrel{Cu}{→}$2CH3CHO+2H2O | |
| D. | 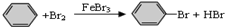 |
20.能正确表示下列反应的离子方程式是( )
| A. | 氢氧化钡溶液与过量稀硫酸反应:OH-+Ba2++SO42-+H+=BaSO4↓+H2O | |
| B. | 碳酸氢钙与过量的NaOH 溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- | |
| C. | 氯化铝溶液与过量的氨水反应:Al3++4OH-=AlO2-+2H2O | |
| D. | 稀硝酸与过量的铁屑反应:3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O |
18.为提纯下列物质(括号中为杂质),所选除杂试剂和分离方法错误的是( )
| 选项 | 被提纯的物质(杂质) | 除杂试剂 | 分离方法 |
| A | KNO3(NaCl) | H2O | 重结晶 |
| B | 乙酸乙酯(乙酸) | 饱和Na2CO3溶液 | 分液 |
| C | 乙醇(水) | 生石灰 | 蒸馏 |
| D | 溴苯(溴) | H2O | 萃取 |
| A. | A | B. | B | C. | C | D. | D |
 .
.