题目内容
11.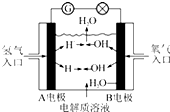 以KOH溶液为电解质溶液的氢氧燃料电池在使用时的电极反应如下:
以KOH溶液为电解质溶液的氢氧燃料电池在使用时的电极反应如下:2H2+4OH--4e-═4H2O;O2+2H2O+4e-═4OH-.据此作出判断,下列说法正确的是( )
| A. | O2在正极,发生氧化反应 | |
| B. | 供电时的总反应为:2H2+O2═2H2O | |
| C. | 外电路中电流由A电极通过导线流向B电极 | |
| D. | 燃料电池的能量转化率可达100% |
分析 氢氧燃料电池是将化学能转变为电能的装置,工作时,通入氢气的一极为电池的负极,发生氧化反应,通入氧气的一极为电池的正极,发生还原反应,电池总反应与氢气在氧气中燃烧的化学方程式一致,产物为水,对环境物污染.
解答 解:A、由电极反应式可知,通入氧气的一极为电池的正极,发生还原反应,故A错误;
B、电池总反应与氢气在氧气中燃烧的化学方程式一致,供电时的总反应为2H2+O2═2H2O,故B正确;
C、电流由正极B电极通过导线流向负极A电极,故C错误;
D、氢氧燃料电池是将化学能转变为电能的装置,还会伴有热能等能量的释放,能量转化率不会达100%,故D错误.
故选B.
点评 本题考查原电池的组成以及工作原理,题目难度不大,注意电极反应式以及能量的转换形式.

练习册系列答案
相关题目
1.下列实验能达到实验目的且符合安全要求的是( )
| A. | 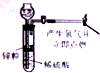 制备并检验氢气的可燃性 | B. | 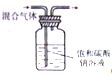 除去CO2中的HCl | ||
| C. | 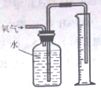 测量O2的体积 | D. | 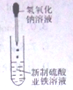 制备氢氧化亚铁并观察其颜色 |
2.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
| A. | 电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-═Cl2 | |
| B. | 氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- | |
| C. | 粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-═Cu2+ | |
| D. | 钢铁发生电化学腐蚀的负极反应式:Fe-3e-═Fe3+ |
6.下列各组物质中,第一种是酸,第二种是混合物,第三种是碱的是( )
| A. | 硫酸、CuSO4•5H2O、苛性钾 | B. | 硫酸、空气、纯碱 | ||
| C. | 硝酸、食盐水、烧碱 | D. | 氧化铁、胆矾、熟石灰 |
16.只用一种试剂一次性鉴别NH4Cl、Na2SO4、(NH4)2SO4三种物质的试剂是(可加热)( )
| A. | AgNO3 | B. | 稀H2SO4 | C. | 稀HCl | D. | Ba(OH)2溶液 |
3.下列有机物的命名正确的是( )
| A. | 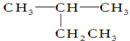 2-乙基丙烷 2-乙基丙烷 | B. | CH3CH2CH2CH2OH 1-丁醇 | ||
| C. |  间二甲苯 间二甲苯 | D. | 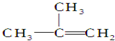 2-甲基-2-丙烯 2-甲基-2-丙烯 |
20.下列与化学反应能量变化相关的叙述正确的是( )
| A. | 一个自发反应,反应物的总能量必须高于生成物的总能量 | |
| B. | 在等温条件下,化学反应的热效应称为焓变 | |
| C. | 化学反应中,发生能量变化的根本原因是化学键的断裂与形成 | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 |