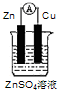
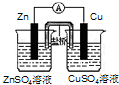
题目内容
1.已知下列两个热化学方程式;H2(g)+$\frac{1}{2}$O2(g)═H2O(1);△H=-285.6kJ/mol
C3H8(g)+5O2(g)═3CO2(g)+4H2O(1);△H=-2220.0kJ/mol
(1)实验测得H2和C3H8的混合气体共5mol,完全燃烧生成液态水时放热6264kJ,则混合气体中H2和C3H8的体积比是1:1.
(2)已知:H2O(1)═H2O(g);△H=+44.0kJ/mol写出丙烷燃烧生成CO2和气态水的热化学方程式C3H8(g)+5O2(g)═3CO2(g)+4H2O(g)△H=-2044kJ/mol.
分析 (1)计算H2和C3H8的平均燃烧热,根据十字交叉法计算H2和C3H8的体积比即可;
(2)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减,反应热也处于相应的系数进行相应的加减,构造目标热化学方程式.
解答 解:(1)由热化学方程式可知,氢气的燃烧热为285kJ/mol,丙烷的燃烧热为2220.0kJ/mol,H2和C3H8的混合气体共5mol,完全燃烧生成液态水时放热6264kJ,则混合气体中,H2和C3H8的物质的量分别为:xmol和(5-x)mol,所以体积比为285x+2220(5-x)=6264,x=2.5mol,所以物质的量之比为:2.5mol:(5-2.5)mol=1:1,
故答案为:1:1;
(2)已知:①C3H8(g)+5O2(g)═3CO2(g)+4H2O(1);△H=-2220.0kJ/mol
②H2O(1)=H2O(g);△H=+44.0kJ/mol
由盖斯定律可知,①+②×4得C3H8(g)+5O2(g)═3CO2(g)+4H2O(g)△H=-2044kJ/mol,
故答案为:C3H8(g)+5O2(g)═3CO2(g)+4H2O(g)△H=-2044kJ/mol.
点评 本题考查反应热的计算、盖斯定律等,难度中等,(1)中也可利用十字交叉法计算,比常规方法简单,容易计算,注意对十字交叉法的理解.

练习册系列答案
相关题目
11.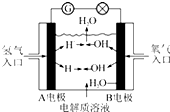 以KOH溶液为电解质溶液的氢氧燃料电池在使用时的电极反应如下:
以KOH溶液为电解质溶液的氢氧燃料电池在使用时的电极反应如下:
2H2+4OH--4e-═4H2O;O2+2H2O+4e-═4OH-.据此作出判断,下列说法正确的是( )
 以KOH溶液为电解质溶液的氢氧燃料电池在使用时的电极反应如下:
以KOH溶液为电解质溶液的氢氧燃料电池在使用时的电极反应如下:2H2+4OH--4e-═4H2O;O2+2H2O+4e-═4OH-.据此作出判断,下列说法正确的是( )
| A. | O2在正极,发生氧化反应 | |
| B. | 供电时的总反应为:2H2+O2═2H2O | |
| C. | 外电路中电流由A电极通过导线流向B电极 | |
| D. | 燃料电池的能量转化率可达100% |
12.下列有关离子(或物质)的检验及结论正确的是( )
| A. | 向黄色溶液中加入淀粉,溶液变蓝色,则溶液中含有I2 | |
| B. | 向无色溶液中加入BaCl2溶液有白色沉淀出现,则溶液中含有SO42- | |
| C. | 向无色溶液中加入稀NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸变蓝,则溶液中含有NH4+ | |
| D. | 用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色,则溶液中含有Na+不含K+ |
9.25℃时有三瓶溶液:pH=3的盐酸、pH=3的醋酸溶液和pH=11的氢氧化钠溶液,下列说法正确的是( )
| A. | 中和等体积的pH=11的氢氧化钠溶液,所需pH=3的醋酸溶液的体积大于pH=3的盐酸的体积 | |
| B. | 往上述盐酸、醋酸溶液中分别加入少量相同的锌粒,盐酸中的锌粒先反应完全 | |
| C. | 将上述醋酸溶液、氢氧化钠溶液混合得到pH=7的溶液,该溶液中c(Na+)大于c(CH3COO-) | |
| D. | 25℃时pH=3的盐酸、pH=3的醋酸溶液中水电离出的c(H+)均为10-11 mol•L-1 |
16.常温下,铝与下列溶液作用产生H2的是( )
| A. | 浓硫酸 | B. | 氢氧化钠溶液 | C. | 浓硝酸 | D. | 稀硝酸 |
6.下列说法中正确的是( )
| A. | 在任何状况下,1 mol CO2和1 mol H2O所含的分子数和原子数都相等 | |
| B. | 只有在标准状况下,1 mol气体所占的体积才是22.4 L | |
| C. | 某物质含有阿伏加德罗常数个微粒,该物质在标准状况下体积为22.4 L | |
| D. | 22.4 L CO所含的分子数为6.02×1023个 |
13.如图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略).
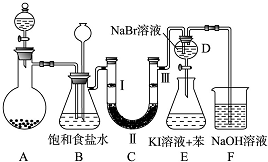
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
装置B中饱和食盐水的作用是除去Cl2中混有的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗中液面上升,形成水柱.
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入d.
(3)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱.当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为橙色,说明氯单质的氧化比溴单质强.
打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象液体分为两层,上层液体显紫红色.

(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
装置B中饱和食盐水的作用是除去Cl2中混有的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗中液面上升,形成水柱.
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入d.
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象液体分为两层,上层液体显紫红色.