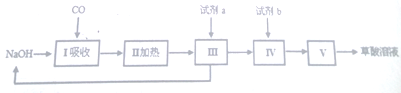
题目内容
20.下列与化学反应能量变化相关的叙述正确的是( )| A. | 一个自发反应,反应物的总能量必须高于生成物的总能量 | |
| B. | 在等温条件下,化学反应的热效应称为焓变 | |
| C. | 化学反应中,发生能量变化的根本原因是化学键的断裂与形成 | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 |
分析 A.反应能否自发进行,取决于焓变和熵变的综合判据;
B.焓变指的是等压条件下的热效应;
C.化学反应中均伴随着能量的变化,化学键的断裂和形成是发生能量变化的主要原因;
D.△H与反应的条件无关.
解答 解:A.反应能否自发进行,取决于焓变和熵变的综合判据,反应物总能量高于生成物总能量的反应,为放热反应,但不一定能自发进行,如铝热反应,故A错误;
B.焓变指的是等压条件下的热效应,不是等温条件下,故B错误;
C.化学反应中发生能量变化的根本原因是化学键的断裂与形成,故C正确;
D.同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同,故D错误;
故选C.
点评 本题主要考查了化学反应能量变化的分析判断,题目较简单,注意对基础知识的理解掌握.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
11.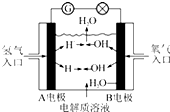 以KOH溶液为电解质溶液的氢氧燃料电池在使用时的电极反应如下:
以KOH溶液为电解质溶液的氢氧燃料电池在使用时的电极反应如下:
2H2+4OH--4e-═4H2O;O2+2H2O+4e-═4OH-.据此作出判断,下列说法正确的是( )
 以KOH溶液为电解质溶液的氢氧燃料电池在使用时的电极反应如下:
以KOH溶液为电解质溶液的氢氧燃料电池在使用时的电极反应如下:2H2+4OH--4e-═4H2O;O2+2H2O+4e-═4OH-.据此作出判断,下列说法正确的是( )
| A. | O2在正极,发生氧化反应 | |
| B. | 供电时的总反应为:2H2+O2═2H2O | |
| C. | 外电路中电流由A电极通过导线流向B电极 | |
| D. | 燃料电池的能量转化率可达100% |
8.如图是立方烷的球棍模型,下列有关说法不正确的是( )


| A. | 其一氯代物有二种 | |
| B. | 其二氯代物有三种同分异构体 | |
| C. | 它是一种烃分子 | |
| D. | 它与苯乙烯(CH5-CH═CH2)互为同分异构体 |
5.下列有关油脂的叙述错误的是( )
| A. | 油脂属于酯类 | B. | 植物油能使溴水褪色 | ||
| C. | 油脂能溶解维生素A | D. | 油脂的水解反应称皂化反应 |
12.下列有关离子(或物质)的检验及结论正确的是( )
| A. | 向黄色溶液中加入淀粉,溶液变蓝色,则溶液中含有I2 | |
| B. | 向无色溶液中加入BaCl2溶液有白色沉淀出现,则溶液中含有SO42- | |
| C. | 向无色溶液中加入稀NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸变蓝,则溶液中含有NH4+ | |
| D. | 用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色,则溶液中含有Na+不含K+ |
9.25℃时有三瓶溶液:pH=3的盐酸、pH=3的醋酸溶液和pH=11的氢氧化钠溶液,下列说法正确的是( )
| A. | 中和等体积的pH=11的氢氧化钠溶液,所需pH=3的醋酸溶液的体积大于pH=3的盐酸的体积 | |
| B. | 往上述盐酸、醋酸溶液中分别加入少量相同的锌粒,盐酸中的锌粒先反应完全 | |
| C. | 将上述醋酸溶液、氢氧化钠溶液混合得到pH=7的溶液,该溶液中c(Na+)大于c(CH3COO-) | |
| D. | 25℃时pH=3的盐酸、pH=3的醋酸溶液中水电离出的c(H+)均为10-11 mol•L-1 |