题目内容
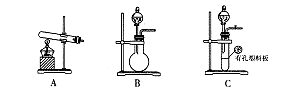
下列实验装置是探究铜丝与过量浓硫酸的反应,下列叙述正确的是 ( )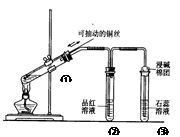
| A.上下移动①中铜丝可控制SO2的量 |
| B.②中品红溶液不褪色 |
| C.③中石蕊溶液变蓝色 |
| D.为确认CuSO4生成,向①中加水,观察溶液颜色 |
A
解析试题分析:在加热的条件下,当铜丝与浓硫酸接触时才能反应,当往上抽动铜丝时,铜丝与硫酸不接触,反应停止,故可通过上下移动①中铜丝可控制SO2的量,故A正确;SO2具有漂白性,品红能被二氧化硫漂白,可用品红溶液验证SO2的生成,故B不正确;SO2为酸性气体,溶于水显酸性,能使石蕊溶液变红色,故C不正确;铜与浓硫酸的反应Cu+2H2SO4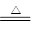 CuSO4+SO2↑+2H2O,实验中,铜丝与过量浓硫酸的反应生成是硫酸铜,试管中含有大量水,不会生成白色固体,CuSO4溶液呈蓝色,为确认CuS04生成,无须向①中加水,故D错误,答案选A。
CuSO4+SO2↑+2H2O,实验中,铜丝与过量浓硫酸的反应生成是硫酸铜,试管中含有大量水,不会生成白色固体,CuSO4溶液呈蓝色,为确认CuS04生成,无须向①中加水,故D错误,答案选A。
考点:考查铜和浓硫酸的反应、二氧化硫的性质
点评:该题是中等难度的试题,试题基础性强,紧扣教材,意在巩固学生的基础,提高学生的实验分析和探究能力,有利于培养学生的学习兴趣,激发学生的学习积极性。答题时注意二氧化硫的酸性和漂白性。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
如图带漏斗U型管中装有足量的煤油和水的混合物,静置后投入一小块碱金属。可观察到金属在煤油和水的界面a附近上下往复运动,下列说法不正确的是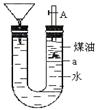
| A.此碱金属可能是钾或钠 |
| B.反应一段时间煤油会燃烧 |
| C.碱金属上下运动是由于与水反应产生了氢气 |
| D.若是金属锂则不能观察到上述现象 |
下列有关实验操作的叙述正确的是
| A.配制FeCl3溶液时,将FeCl3溶解在较浓的盐酸中,再用水稀释到所需浓度 |
| B.进行焰色反应时,所用铂丝先用NaOH溶液洗涤并充分灼烧 |
| C.用CCl4萃取碘水中的I2时,有机层从分液漏斗的上端倒出 |
| D.酸碱中和滴定时,锥形瓶需用待测液润洗2次,再加入待测液 |
下列实验方法正确的是
| A.除去NaCl溶液中的Cl2,可加入酒精后分液 |
| B.滴定管用蒸馏水洗净后,直接装入标准浓度的溶液滴定 |
| C.用排水法收集稀HNO3和Cu反应产生的NO气体 |
| D.用KSCN溶液和氯水鉴别FeCl3溶液中是否含有FeCl2 |
下列实验不能达到目的的是
| A.用AlCl3溶液和过量氨水制备Al(OH)3 |
| B.用NH4Cl和Ca(OH) 2固体混合加热制备NH3 |
| C.用NaOH溶液除去苯中的溴 |
| D.用足量铜粉除去FeCl2溶液中的FeCl3杂质 |
下述实验设计能够达到目的的是( )
| 编号 | 实验目的 | 实验设计 |
| A | 证明盐酸酸性比醋酸强 | 用同一电路测等体积的盐酸、醋酸溶液的导电性 |
| B | 证明H2CO3酸性比H2SiO3强 | 将CO2通入Na2SiO3溶液中 |
| C | 证明钠的金属活动性比铜强 | 向CuCl2溶液中投入金属钠 |
| D | 证明溶液中含有I- | 向溶液中加入淀粉 |

 (3)已知C中有0.1 mol Cl2参加反应。若假设一成立,可推知C中反应的化学方程式为 。
(3)已知C中有0.1 mol Cl2参加反应。若假设一成立,可推知C中反应的化学方程式为 。